Перші та найбільш ліниві
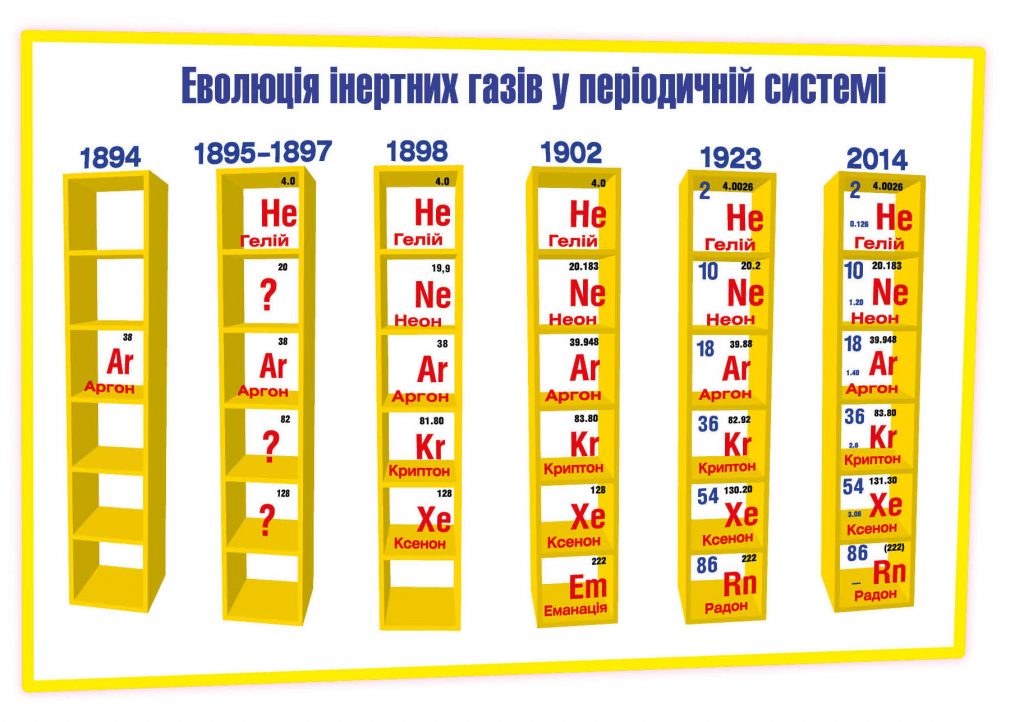
Як відомо, хімія – наука про речовини та закономірності їхніх перетворень. Проте є в природі елементи, яким не до вподоби всі ці перетворення. Це одноатомні інертні гази, які ще називають благородними. Слово „інертний” у перекладі з латини означає „недієвий”, „нерухомий”. Таке ж значення має назва одного з інертних газів, Аргону, але вже у перекладі з грецької. Так його охрестили 1894 року на зборах Британської асоціації природодослідників у Оксфорді, де хімік В. Рамзай і фізик Дж. В. Стретт (лорд Релей) повідомили про відкриття цього елемента. Крім офіційної назви, Аргон отримав і образливе прізвисько, що підкреслює його хімічну пасивність і вперте небажання сполучатися з побратимами з таблиці, –„хімічний мрець”. Над нещасним самітником змилосердився корифей наукової фантастики Г. Веллс. У творі „Війна світів” він вигадав сполуку, нібито залишену на Землі марсіанами: „Спектральний аналіз1 чорного пилу свідчить про наявність невідомого нам елемента: відзначались чотири яскраві лінії у блакитній частині спектру; можливо, цей елемент утворює сполуку з аргоном…”.
1Спектральний аналіз – метод дослідження хімічного складу різних речовин за їхнім випромінюванням.
Лише рік потому В. Рамзай відкрив чергового хімічного ледаря – Гелій. Щоправда, раніше Гелій вже відкрили на Сонці. Відразу два астрономи з різних країн у 1868 році виявили його під час спостереження сонячного затемнення. Один з них, Дж. Н. Лок’єр, і назвав його сонячно – Гелій (від гр. „helios” – сонце). Він допоміг Рамзаю розпізнати свого старого знайомого, коли Рамзай надіслав йому проби виявленого ним газу.
Гелій відкрили за допомогою спектрального аналізу. Цікаво, що саме цей метод пізніше збив з пантелику першовідкривача Гелію. Він вирішив, що Гелій – це суміш двох газів, один з яких дає жовту лінію в спектрі, а інший – зелену. Для другого елемента він також вигадав зіркову назву – Астерій (від гр. „aster”– зірка). Однак Рамзай експериментально довів, що Гелій – це один хімічний елемент, а колір спектральних ліній залежить від тиску газу, тому немає сенсу шукати в таблиці Менделєєва Астерій – його не існує.
Рамзай-провидець
Рамзай визначив місце Аргону і Гелію в періодичній системі хімічних елементів, за його словами, „за зразком нашого вчителя Менделєєва”. З’ясувалось, що в таблиці з’являються порожні комірки між Бромом і Рубідієм, а нижче – між Йодом і Цезієм. Так Рамзай дійшов висновку, що є й інші „ледачі” гази, і всі вони складають окрему групу хімічних елементів. Свою гіпотезу він висловив 1897 року в Торонто на з’їзді Британської асоціації наукових працівників, надихнувши хіміків усього світу на пошуки ще невідкритих газів у мінералах і мінеральних водах. І хто ж, як ви гадаєте, виявив один з передбачених газів за рік? Сам Рамзай! Він назвав його Криптоном, що в перекладі з грецької означає „секретний”, „прихований”.
Буквально за декілька днів Рамзай і його помічник М. Траверс відкрили ще один інертний газ. Цього разу їм не довелось завдавати собі клопоту, вигадуючи назву для цього елемента. Їм допоміг… 12-річний син Рамзая. Спостерігаючи спектр нововідкритого елемента, він поцікавився в батька, як зветься цей гарний газ. Рамзай відповів, що ще не вирішив. Хлопець збагнув, що елемент новий і запропонував назвати його Novum. Щоб не порушувати традицію грецьких назв для хімічних елементів, Рамзай вирішив назвати його Неоном (гр. „новий”).
Мабуть, Рамзай і Траверс увійшли в азарт. Інакше як можна пояснити, що того ж 1898 року вони відкривають ще один новий хімічний елемент? Цей елемент вкрай рідко трапляється на Землі, в атмосфері Сонця, у складі астероїдів і комет. Можливо, з цим пов’язана його назва – Ксенон (з гр. „чужий”, „незвичний”, „нечуваний”).
Після всіх відкриттів Рамзай продовжував роздуми про місце інертних газів у періодичній системі хімічних елементів2. Він навіть обговорював цю проблему з Д. І. Менделєєвим, після чого той написав: „Якщо вважати Аргон і його супутників самостійними хімічними елементами, то їх – через нездатність утворювати … сполуки… – варто помістити в особливу групу, так би мовити, нульову, що передує групі I-ій. Всі вони є одноатомними газами. Їхні атомні ваги є проміжними між атомними вагами галогенів (VII група) і лужних металів (I група)”. Іншими словами, інертні гази за проявлену лінь в утворенні хімічних сполук заслані на нульовий рівень таблиці Менделєєва. Вперше періодичну систему хімічних елементів у такому вигляді представив Л. Еррера на засіданні Бельгійської академії наук 1900 року. А сам Менделєєв виокремив нульову групу у додатку до роботи „Спроба хімічного розуміння світового ефіру” 1902 року.
21904 року Рамзаю присудили Нобелівську премію з хімії „на знак визнання відкриття ним в атмосфері інертних газів і визначення їхнього місця в періодичній системі”.
Останній з благородних
До відкриття останнього з інертних газів – Радона – хіба ледачий не долучився! Розпочалося з експериментів А. Беккереля: він випадково забув фотопластини у шухляді стола разом із сіллю урану. Чи то через скрупульозність, чи то завдяки інтуїції учений вирішив їх проявити і з’ясував, що вони засвічені так, наче були на сонці. Беккерель доповів про загадкове випромінювання в Академії наук. Присутні там Марія та П’єр Кюрі зацікавились цим явищем і прийняли естафету дослідження. Вони з’ясували, що випромінюють самі атоми Урану. Згодом науковці з’ясували, що Торій теж випромінює. Марія Кюрі назвала це явище радіоактивністю (від лат. „radio” – випромінюю, „radius” – промінь і „activus” – дієвий). Брати Жак і П’єр Кюрі винайшли пристрій для вимірювання радіоактивності: він став у нагоді під час пошуку інших радіоактивних елементів. Ці пошуки були довгими і клопіткими, та 1898 року П’єр і Марія Кюрі відкрили ще два таких елементи: Полоній і Радій. 1903 року А. Беккерель і подружжя Кюрі отримали Нобелівську премію з фізики за відкриття та вивчення радіоактивності.
П’єр і Марія помітили, що тіла поряд з радіоактивним джерелом стають радіоактивними. Резерфорд пояснив це явище тим, що відбувається щось на зразок перетікання радіоактивності, або еманація (від лат. „emanation” – витікання). Вона навіть викликає свічення (фосфоресценцію) деяких речовин. Пізніше Резерфорд і Содді (1902 року) довели, що еманація Радію є газоподібною речовиною. Резерфорд запропонував назвати цей газ Emanation (скорочення – Em). Пізніше вчені з’ясували, що еманацію утворюють не лише препарати Радію, але й Торію та Актинію. Щоб їх розрізняти, еманацію Радію назвали Radium Emanation (RaEm). Ще одну назву – Нітон (Niton), що у перекладі з латини означає „блискучий”, – запропонував Рамзай, який разом з Греєм 1908 року вперше виділив цей інертний газ у чистому вигляді та визначив його атомну вагу. Хіміки вважали цю назву невдалою, і 1923 року газ перейменували на Радон, а символ Em змінили на Rn.
Як побороти лінощі
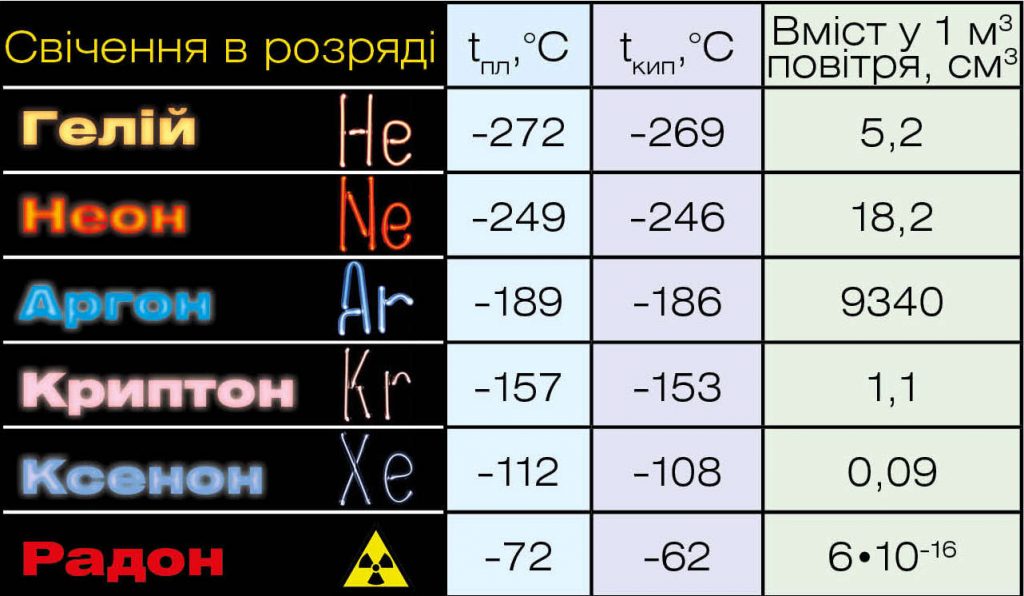
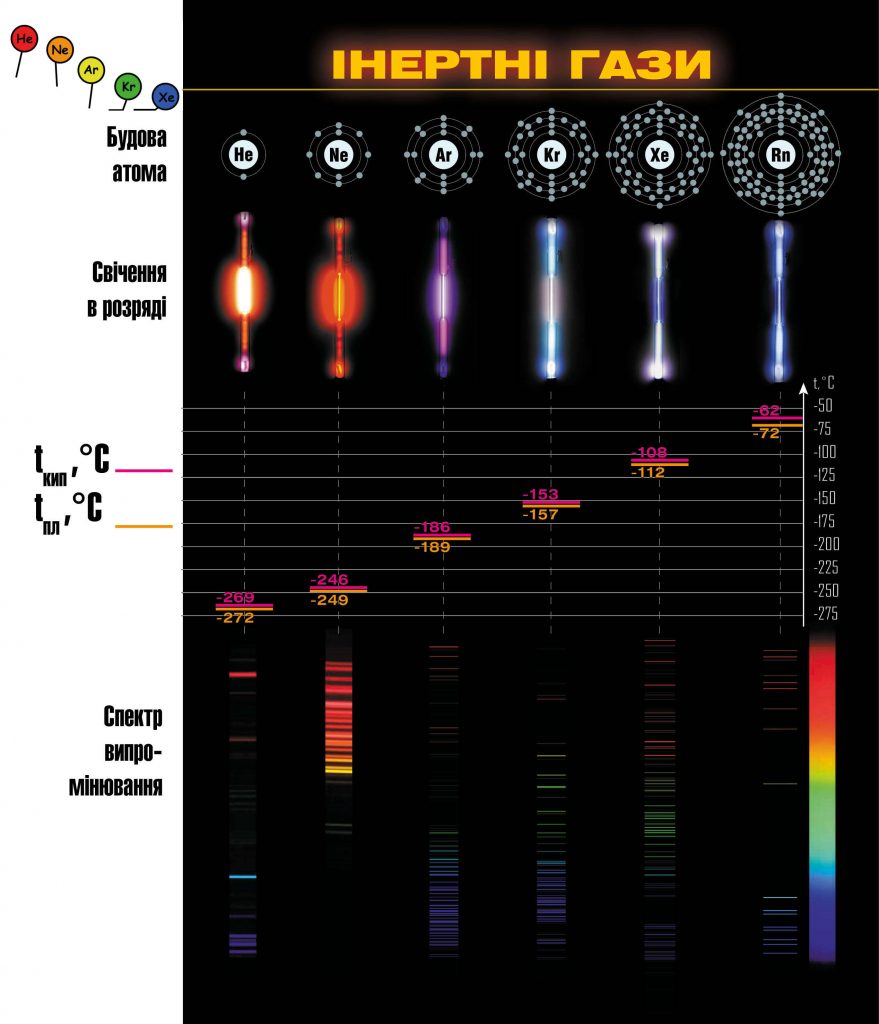
Отже, всі інертні гази відкриті і знайшли своє місце в періодичній системі хімічних елементів. Небажання представників нульової групи входити до складу будь-яких сполук теж пояснили: їхня зовнішня електронна оболонка повністю заповнена, ділитися електронами їм нелегко, але й на чужі електрони вони не зазіхають. Як бачимо, до звинувачення в лінощах додалось звинувачення в жадібності. З’явився жарт: „Що робить благородний газ, коли його звинувачують у жадібності? Він не реагує”. Та хіміки стали на захист репутації інертних газів і вирішили довести, що вони здатні на нормальні хімічні стосунки. І намагання науковців не були марними: поблизу абсолютного нуля гелій вступає в реакцію з металами (меркурієм, паладієм, платиною та іншими).
Справді складно цих „скнар” змусити ділитися електронами! Та знайшлася людина, якій це виявилося до снаги. Канадський хімік Нейл Бартлетт вивчав платини гексафторид і з’ясував, що ця сполука здатна забрати електрон у самого кисню! А це вкрай непросте завдання, адже кисень сам полюбляє забирати чужі електрони, і аж ніяк не навпаки. Тоді Бартлетт замислився: чи не зможе платини гексафторид забрати електрон і в якогось інертного газу? У посудину з перегородкою вчений помістив ксенон і газоподібний платини гексафторид. Бартлетт вийняв перегородку, гази змішалися, і вмить утворилась жовта речовина. Так 1962 року була отримана перша сполука інертного газу.
Тепер називати їх інертними язик не повертається. На щастя, вчені називали їх також благородними газами за аналогією з благородними металами. А розділ хімії, що вивчає ці гази, отримав назву „хімія благородних газів”.
Революція у періодичній системі
Оскільки більшість благородних газів утворюють сполуки, хіміки зглянулися на них, перемістивши з нульової групи одразу до восьмої. Це було справжньою перебудовою періодичної системи хімічних елементів! Невідомо хто першим зважився на ці радикальні зміни, але за 100 років після появи таблиці Менделєєва вона набула нового вигляду, більш логічного і відповідного до рівня розвитку тогочасної хімії.
Однак два благородних гази хоча й „переїхали” до восьмої групи, поки що не бажають за нормальних умов сполучатися з іншими речовинами: Гелій і Неон. Не будьмо з ними занадто суворими: у чистому вигляді вони не байдикують, а працюють у поті чола, не зважаючи на своє благородство. Гелієм наповнюють повітряні кулі і дитячі кульки, а Неон „працює” у рекламному бізнесі та підсвічує численні рекламні вивіски.
Щодо Аргону, то його сполуку всупереч „бездіяльній” назві елемента і на підтвердження космічних вигадок Г. Веллса 2013 року виявили в космосі. Вивчаючи за допомогою космічної обсерваторії „Гершель” склад пилу Крабоподібної туманності, науковці зафіксували в спектрі нові яскраві лінії. Виявилось, що це випромінювання атомів Аргону та йонів сполуки Аргону і Гідрогену. Аргон гідрид – це перша сполука благородного газу, виявлена в космічному просторі. У зв’язку з цим відкриттям вчені висунули нові гіпотези щодо процесу завершення еволюції масивних зір, які ще належить перевірити. Можливо, благородні гази ще не раз здивують нас!