Роботу виконав:
Гажа Максим Вадимович,
учень 9-Б класу
Переяслав-Хмельницької
загальноосвітньої школи І-ІІІ ступенів №2
Науковий керівник:
Бован Ніна Петрівна,
учитель фізики та астрономії
Переяслав-Хмельницької
загальноосвітньої школи І-ІІІ ступенів №2,
лауреатка IV Всеукраїнського Інтернет-конкурсу
„УЧИТЕЛЬ РОКУ–2019” за версією
науково-популярного природничого журналу
„КОЛОСОК” у номінації „Фізика і астрономія”
Рецензент:
Філоненко Михайло Миколайович,
кандидат фізико-математичних наук,
доцент кафедри експериментальної і
теоретичної фізики та астрономії
НПУ імені М.П.Драгоманова
ВСТУП
Тобою насолоджуються,
не відаючи, що ти таке
Антуан де Сент Екзюпері
Ми живемо у ХХI столітті, в епоху розвитку різних видів мистецтва, техніки, науки.
Сьогодні наявні усі можливості для створення покращених умов життя людини: лабораторії оснащені найновітнішими пристроями; безліч комунікаційних систем; потужна мережа поширення знань та потрібної інформації; фінансова підтримка молодих дослідників; пропаганда пізнання світу та його складових. Надзвичайно гостро стоїть питання раціонального використання енергетичних ресурсів. Використання меншої кількості енергії для забезпечення того ж рівня енергетичного забезпечення будівель або технологічних процесів на виробництві.
Не секрет, що перехід на відновлювальні джерела енергії справа непроста і довготривала. Зараз значна частина електроенергії − це електроенергія, що виробляється атомними електростанціями. При наявності в Україні чотирьох атомних електростанцій потужністю 13880 МВт (на 01.01.2017) [18], Уран відіграє значну роль у забезпеченні країни електроенергією. Його частка у виробництві електроенергії, в порівнянні з іншими енергоносіями, постійно зростає. Так у 2014 р. АЕС виробили 50,09%) [2, c.98]. Вода є невід’ємною частиною процесу вироблення цієї електроенергії (охолодження відбувається за допомогою води). Надзвичайно широко використовується вода у побуті в системах опалювання. Актуальність дослідження полягає в тому , що нам необхідно знати якнайбільше про ту речовину, яку всі ми так широко використовуємо в побуті та промисловості. Знання її властивостей допоможе краще усвідомити ті процеси, що відбуваються довкола нас.
Мета роботи полягає в тому, щоб розглянути процес нагрівання води і спробувати встановити закономірності швидкості нагрівання води в залежності від її хімічного складу.
Для досягнення мети потрібно виконати такі завдання:
- опрацювати теоретичні джерела інформації з фізико-хімічних властивостей води;
- дослідити різні джерела інформації, що стосуються аномальних властивостей води;
- встановити, які фактори впливають на швидкість нагрівання води;
- провести порівняльний аналіз різних чинників, які впливають на швидкість нагрівання води.
Для проведення дослідження було використано такі методи:
- емпіричні: спостереження, вимірювання, експеримент;
- теоретичні: аналізу, синтезу, індукція та дедукція, систематизації, узагальнення.
Наукова новизна полягає в тому, що під час проведення дослідження практичного матеріалу було встановлено залежність швидкості нагрівання води від різних чинників. На основі опрацьованого матеріалу та результатів проведених досліджень можна стверджувати, що наявність і кислот, і лугів у воді є причиною того, що вода нагрівається довше.
Теоретичне значення: дана робота може бути корисною для поглиблення знань про воду та її властивості, прогнозування часу нагрівання рідин.
Практичне значення: матеріал дослідження можна використати для проведення факультативних занять із фізики, астрономії, біології.
Ідеї та аналітичні розробки, здійснені в дослідженні, можуть бути корисними для забезпечення енергоефективності.
Вода – дорогоцінний дар природи, що забезпечує життя на Землі. Здавалося б, не існує нічого більш звичного, ніж вода, проте все ж немає нічого загадковішого.
РОЗДІЛ 1. ТЕОРЕТИЧНІ ОСНОВИ ДОСЛІДЖЕННЯ ТЕМИ
1.1. Фізичні характеристики води
Чиста вода — безбарвна прозора рідина, без запаху і смаку. На Землі вода існує в трьох агрегатних станах — твердому, рідкому та газоподібному. За нормального атмосферного тиску при 0°С вона замерзає і перетворюється у лід, а при 100°С — кипить, перетворюючись у пару. У газоподібному стані вода існує і за нижчої температури, навіть нижче 0°С. Тому лід і сніг теж поступово випаровуються. У рідкому стані вода практично не стискається, при замерзанні розширюється на 1/11 від свого об’єму [11].
Найбільшу густину вода має при +4°С. Масу 1 см³ чистої води при цій температурі прийняли за одиницю і назвали грамом (сучасне визначення грама засноване на точнішому еталоні). На відміну від інших рідин, вода при охолодженні від + 4 до 0°С розширюється [7].
Потрійна точка води, тобто умови, за яких одночасно у рівноважному стані можуть співіснувати вода, лід та пара, реалізується при температурі 0,01 °C і тиску 611,73 Па. Значення 0,01 °C точне — на ньому засноване визначення одиниці вимірювання температури в Міжнародній системі (СІ), Кельвіна. Проте відповідно до запропонованих змін у СІ, коли значення сталої Больцмана та числа Авогадро буде зафіксовано, температура потрійної точки води буде визначатися з похибкою [13].
Вода характеризується великою питомою теплоємністю, що дорівнює за означенням калорії 1 кал/г-град. Завдяки цьому температура океанів і морів змінюється досить повільно і цим регулюється температура на поверхні земної кори. Цим пояснюється також те, що клімат на островах рівномірніший, ніж на материках.
Фізичні властивості води великою мірою зумовлені тим, що її молекули мають значний дипольний момент (1,844 Дебая).
У будь-який момент часу в рідкій воді більшість молекул утворюють водневі зв’язки, проте час життя кожного з них дуже короткий (від 1 до 20 пс). Після руйнування одного зв’язку наступний, із тим же або іншим партнером, утворюється приблизно через 0,1 пс. Тимчасові групи молекул води, сполучених між собою водневими зв’язками, називають «кластерами, що мигають». Сила водневих зв’язків досить невелика (енергія розриву 23 кДж/моль), проте вони дуже суттєво впливають на властивості води, через їх велику кількість.
Завдяки своїй формі молекули води можуть сполучатись водневими зв’язками із чотирма іншими. Саме таким чином вони організовані у кристалах льоду. Проте в рідкій воді молекули менш впорядковані і перебувають у стані постійного руху, тому середня кількість зв’язків, що утворюються кожною із них, в будь-який момент часу становить 3,6 [10].
У воді виявлено наявність когерентних дальнодіючих диполь-дипольних взаємодій, як в льоду. Це означає, що структура рідкої води має більше схожості з льодом, ніж вважалося раніше. Великий асортимент і просторове поширення когерентного режимів свідчить про існування широкої мережі водневих зв’язків, на відміну від більш ранніх уявлень про структуру води, які розглядали подібну динаміку тільки для невеликих молекулярних кластерів [11].
1.2. Аномалії води
Вода є гідридом кисню — елемента шостої групи. Хімічні аналоги води: H2S, H2Fe, H2Se, H2Po. Для кожного з них відома температура кипіння, яка рівномірно змінюється від сульфуру до полонію. Якщо ми нанесемо ці температури на графік і продовжимо лінію точок кипіння в сторону води, то побачимо, що для води температура кипіння має бути —80 °С. Але ми добре знаємо, що вода кипить при температурі 100 °С. Виявляється, що це одна з її незвичайних і дивних властивостей [1, с.11].
Гідрид кисню, враховуючи його положення в таблиці Менделєєва, повинен був би тверднути при температурі −100 °С.
Але вода замерзає при 0 °С. Це її друга дивна властивість. Досліджуючи й аналізуючи властивості води, вчені назвали їх аномаліями.
Перша аномалія — це виключно висока теплоємність води порівняно з іншими рідинами і твердими тілами, яку при 15 °С вважають рівною 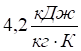 , тоді як значення теплоємності для ртуті та платини –
, тоді як значення теплоємності для ртуті та платини – 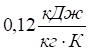 , заліза та міді —
, заліза та міді — 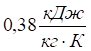 ; піску, скла —
; піску, скла — 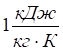 , повітря —
, повітря — 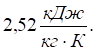 ; деревини — машинне мастило –
; деревини — машинне мастило – 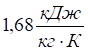 [17].
[17].
Через особливу здатність води поглинати теплоту її температура під час нагрівання й охолодження змінюється мало, тому морським і річковим мешканцям ніколи не загрожують ні сильне перегрівання, ні надмірне охолодження. Відмінність між теплоємностями води і ґрунту є однією з причин, що визначають різницю між морським і континентальним кліматом. Нагріваючись приблизно в п’ять разів повільніше, ніж ґрунт, вода у стільки саме разів повільніше охолоджується. Завдяки цій особливості моря й океани є потужними акумуляторами теплоти. Постійно віддаючи її атмосфері, вони пом’якшують клімат Землі. Через високу теплоємність воду широко використовують як теплоносій у теплосиловому та комунальному господарстві, а також як охолоджувач у разі необхідності зниження температури [6].
Друга й третя аномалії води пов’язані з першою: у воді найвища в світі мінералів прихована теплота випаровування і плавлення, тобто та кількість теплоти, яка необхідна для перетворення рідини на пару та льоду на рідину. Наприклад, щоб перетворити 1 кг льоду на рідину, необхідно затратити 2,3МДж. Сама ж речовина (лід—вода) зовсім не підвищує свою температуру. Температура льоду, що тане, незмінно однакова: 0°С. В той же час вода з навколишнього середовища повинна поглинати 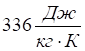 теплоти. Але уточнюємо: якщо лід тане при температурі 0 °С та нормальному тиску, то для плавлення 1 кг льоду, що має температуру -7 °С, достатньо 320 кДж, а при -3°С — 306 кДж. Виходить, що з кожним градусом униз по шкалі термометра теплота плавлення льоду зменшується на 0,5 °С. Чи не дивно? Чим холодніший лід, тим легше перетворити його на воду. Це і є наступна примха води.
теплоти. Але уточнюємо: якщо лід тане при температурі 0 °С та нормальному тиску, то для плавлення 1 кг льоду, що має температуру -7 °С, достатньо 320 кДж, а при -3°С — 306 кДж. Виходить, що з кожним градусом униз по шкалі термометра теплота плавлення льоду зменшується на 0,5 °С. Чи не дивно? Чим холодніший лід, тим легше перетворити його на воду. Це і є наступна примха води.
Подібне ми спостерігаємо і під час перетворення води на пару. Щоб випарувати воду з чайника, теплоти необхідно в 5,5 раза більше, ніж для того, щоб закип’ятити її без підвищення температури кипіння води, яка стала і (при тиску в 1 атм.) дорівнює 100 °С. Звичайно, ці ж 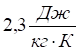 кожен кілограм пари віддає в навколишнє середовище, конденсуючись у воду. Коли б не ця властивість води — навіть у спеку випаровуватися повільно — багато озер і річок улітку пересихали б до дна [5].
кожен кілограм пари віддає в навколишнє середовище, конденсуючись у воду. Коли б не ця властивість води — навіть у спеку випаровуватися повільно — багато озер і річок улітку пересихали б до дна [5].
Четверта аномалія полягає в наступному. Замерзаючи, вода розширюється на 9 % порівняно з початковим об’ємом. Густина звичайного льоду — 924 кг/м3, тому він легший від води і спливає на її поверхню. Коли б цієї аномалії не було, то лід не зміг би плавати, водойми промерзли б до дна і все живе загинуло б [1, с.14].
Ми кажемо: «Звичайний лід». Учені виявили шість різновидів льоду. З підвищенням тиску точка переходу води в лід знижується. Якщо заморозити воду при температурі -170 °С (за звичайного тиску), з неї утворюється дуже щільний лід. Він тоне у воді, оскільки його густина — 2300 кг/м3. Але найцікавішим із шести існуючих різновидів льоду є «гарячий лід», який отримують під тиском 21 000 атм. Він має температуру +76 °С. Такий лід можна отримати безпосередньо з води при температурі +60 °С і тиску 16500атм. «Гарячий лід» плавиться при температурі +192 °С і тиску 32 000 атм. І не дивно, якщо в надрах Землі (на глибині в декілька сотень кілометрів) виявляють гарячий лід. Гарячий у повному розумінні цього слова [8].
П’ята аномалія найбільш незвичайна. Усі речовини під час нагрівання розширяються, а при охолодженні стискаються. Вода також стискається під час охолодження. Але вона стискається до тих пір, поки її температура не досягне +4 °С. Потім вона знову починає розширюватися, хоча температура й знижується: найважча вода — при 4 °С вище нуля (1 м3 має масу 1 т.). Тому зимою, охоловши до +4 °С, вона опускається на дно водойми і зберігається там протягом усієї зими, не замерзаючи. Ця властивість води рятує життя всіх прісноводних тварин, що зимують у річках, ставках, озерах.
Шоста аномалія пов’язана з тим, що вода, як і ртуть, має найбільший поверхневий натяг. Усередині рідини притягання молекул одна до одної врівноважується, а на поверхні — ні. Молекули води, які розміщені глибше, тягнуть донизу верхні молекули. Тому крапля води начебто намагається затягти себе у вузлик. Стягують її сили поверхневого натягу. Крапля води упакована в свою поверхневу плівку, яка дуже міцна. Щоб розірвати її, потрібна сила, і немала. По цій плівці бігають комахи — вертячки та водоміри, по ній повзуть равлики з масивними раковинами і навіть ящірки-василіски. Усі вони важчі за воду, але не тонуть: плівка підтримує їх [1, с.16].
Фізики точно розрахували, яку гирю треба підвісити до стовпчика води завтовшки 3 см, щоб розірвати його. Маса такої гирі величезна — понад 100 т. Це для абсолютно чистої вводи. У природі такої води немає, в ній завжди щось розчинено. Нехай хоч небагато, але чужорідні речовини розривають зв’язки між молекулами води і сили зчеплення між ними зменшуються. Але капілярність зберігається і відіграє суттєву роль у живій природі. Своєрідними капілярами є коріння рослин. Сили поверхневого натягу тягнуть воду вгору із глибини ґрунту, живлячи рослини солями і вологою. Під дією сил поверхневого натягу кров наповнює капіляри тварин і людей. Важко уявити собі картину життя на Землі при зменшенні поверхневого натягу води.
Сьома аномалія полягає в тому, що вода — найкращий розчинник. Вона розчиняє дуже багато речовин, проте сама залишається інертною і не змінюється від багатьох речовин, які розчинює. Завдяки цьому вода змогла стати носієм життя.
Усі ми знайомі з кругообігом води в природі. А яким свіжим буває повітря після дощу! Дощова вода чи сніг — це фільтр атмосфери. Тож звернемо увагу на розчинні здатності води.
Уявімо, скільки тисяч вулканів протягом усіх геологічних епох викидали в атмосферу Землі отруйні гази і пил. Коли б усе це залишалося в повітрі, ні один промінець Сонця не зміг би сьогодні проникнути крізь густу чорну млу, що оточила б планету. Ні один мікроб не вижив би в її отруйному середовищі. А що вже говорити про тваринний чи рослинний світ? На наше щастя, скільки років діють вулкани, стільки ж років випадають на Землю дощі. Пронизуючи повітряну оболонку планети, краплі води захоплюють пилюку і розчиняють у собі отруйні гази. А зараз діяльність вулканів доповнюється бурхливою «діяльністю» заводських труб та вихлопних труб автомобілів. Зростає забруднення повітря також через втручання людини. І дощам усе важче справлятися зі своїми фільтруючими «обов’язками». Виникає запитання: якщо вода розчиняє всі гази, що є в атмосфері Землі, то чому ж вона не розчиняє в собі саму атмосферу, крізь яку падає дощем, і яка є сумішшю газів?
Справа в тому, що повітря, яке оточує Землю, також розчиняється у воді, але воно безперервно поповнюється рослинами планети. Цікаво, що 1,5 млн км3 вільного кисню, який міститься в атмосфері, вимагав би розкладу 1,6 млн км3 води, що приблизно дорівнює 20-ти об’ємам Каспійського моря.
Таким чином, увесь атмосферний кисень поновлюється тільки за 3,2 тис. років. Безповоротне поглинання повітря призвело б до безперервного зниження атмосферного тиску, що, в свою чергу, викликало б інтенсивне випаровування води. Випаровуючись, вода повинна розчиняти в собі гази. До того ж кількість розчиненого у воді газу визначається ступенем насичення, тобто не може бути як завгодно великим. Отже, вода — своєрідне реле тиску атмосфери. Тиск повітря, що оточує нас, з дуже незначними коливаннями має стале значення — 760 мм рт. ст. [1, с.21]
Незрозумілою залишається й інша обставина: чому під час випаровування води в атмосферу повертаються не всі розчинені нею гази, а тільки азот і кисень. Яким чином вдається воді втримати такий активний елемент, як кисень, від реакцій з іншими розчиненими в ній речовинами? Знову загадка води!
1.3. Різновиди води
1.3.1. Жива вода
Через безліч казок та переказів різних народів і часів пройшла легенда про «живу» воду. Вона зцілювала рани, оживляла мертвих, надавала сміливості та стократно збільшувала сили. І не випадково людина наділяла воду такими магічними властивостями. Коріння цих уявлень заховані в глибині віків.
У древніх книгах є свідчення, що 4 000 років тому хворих лікували в купелі при храмах. Хитромудрі грецькі жерці суворо берегли таємниці свої від непосвячених, добре знали цілющу силу мінеральної води. Вони будували храми Ескулапа поблизу джерел та старанно їх оберігали.
Про цілющі властивості мінеральних вод знали ще галли. Археологи знайшли біля деяких джерел вівтарі, побудовані на честь бога Борво («киплячий»). З часів Римської імперії збереглися плити з висіченими на них написами, що вказували дорогу до «священних вод Теркумса», покликаних служити «здоров’ю та радості» [1, с.25].
Із мінеральних вод найціннішими з біологічного погляду є вуглекислі. Під їх дією розширюються капіляри шкірного покриву і кров рівномірно перерозподіляється в організмі, не вимагаючи додаткових зусиль від серця.
Завдяки вуглекислоті нормалізується кровообіг, покращуються обмінні процеси в тканинах серця, підвищується його працездатність. Ось чому лікарі рекомендують вуглекислі ванни при деяких серцево-судинних захворюваннях.
Лікувальні властивості мінеральної води визначаються перш за все вмістом у ній солей. Ця характеристика називається мінералізацією води і може бути найрізноманітнішою.
Якщо мінералізація не виходить за межі 2-8 г/л — вода називається лікувально-столовою. А бувають води зі вмістом 12-52 г/л. На організм людини вони здійснюють сильний вплив, тому їх відносять до лікувальних; п’ють цю воду лише за призначенням лікаря і в строго обмеженій кількості. За багатством та різноманітністю мінеральних вод Україна відома всьому світу. Широко відомі лікувальні та столові води: «Миргородська», «Березовська», «Свалява», «Поляна Квасова», «Лужанська», «Київська». Десятки тисяч людей щорічно відпочивають на 42-х курортах України: в Криму, Карпатах, Одесі, Моршині, Миргороді, Слов’янську, Трускавці, Миронівці, Бердянську, Хмільнику та інших живописних здравницях, використовуючи мінеральні води майже всіх різновидів [1, с.28].
У чому ж секрет чудодійних властивостей мінеральних вод, що прийшли із земних надр? А чи не можна штучно приготувати цілющі мінеральні води? Деякі спеціалісти стверджували, що цілющі властивості мінеральної води визначаються її хімічним складом, тобто тими солями, що в ній розчинені. Користуючись сучасними методами аналізу, встановили точний хімічний склад води і шляхом синтезу приготували штучну мінеральну воду. Приготували, склад води відтворили, але цілющих властивостей не отримали.
Очевидно, справа не лише і не стільки в розчинених речовинах, скільки у властивостях самого розчинника, тобто у властивостях води. У яких саме? Вода в мінеральних джерелах — це вода, що прийшла з великих глибин. Там вона піддавалася дії високих температур, високих тисків і, можливо, пройшла якусь ще невідому нам обробку. Пройшовши шлях із глибини до поверхні, вона зберегла (хай і частково) набуті нею властивості, а людство отримало від природи джерело бадьорості й здоров’я [5].
Україна багата на мінеральні води: радіоактивні, сірководневі, вуглекислі. До радіоактивних належать радонові, радонорадієві, вуглекисло-радонові. Найвідомішим курортом в Україні, де згадані води використовують у лікувальних цілях, є місто Хмільник Вінницької області. Сірководневі мінеральні води трапляються переважно в передгір’ї Карпат, у Закарпатті та Криму. Вуглекислі води — найцінніші за лікувальними властивостями. Такі джерела є у гірських районах Карпат [14].
1.3.2. Срібна вода
Цілющі властивості води, яких вона набуває після контакту з металічним сріблом, були відомі давно. Про це свідчать історичні книги, праці з медицини. Історик античного світу Геродот свідчить, що в V ст. до н. е. персидський цар Кір під час походів користувався водою, що зберігалася в срібних «священних» посудинах. В індуських релігійних книгах є згадки про обеззаражування води шляхом короткочасного занурення в неї розжареного срібла. У деяких країнах існував звичай: під час освячування колодязів кидати в них срібні монети, а також зберігати воду в срібних чашах. Вважали, що це покращує якість води. Мабуть, багато хто з вас чув рекламу про срібні кульки, що забезпечують очищення води [4].
Нині відомо, що срібло має вищий антимікробний ефект, ніж пеніцилін, біоміцин та інші антибіотики. Вода, що містить 1 мг/м3 срібла, добре інактивує віруси грипу різних штамів. Навіть при значно менших концентраціях (0,1—0,4 мг/м3) вона здатна вбивати багато мікроорганізмів, що викликають небезпечні водні епідемії. При цьому дія стороннього фактору (в даному випадку незначна кількість срібла) не залишає видимих «слідів на воді» (колір, смак, запах, агрегатні стани її залишаються незмінними), але вода набуває властивостей, що перетворюють її на цілющу.
Використання срібла для обеззаражування води є найефективнішим методом дезинфекції та консервування питної води. Його використовують, коли застосування хлору протипоказане: на суднах, у плавальних басейнах, у польових умовах [1, с.33].
Срібло є прекрасним консервантом мінеральної води. Багато років на Харківському, Тальнівському, Київському, Дніпропетровському заводах безалкогольних напоїв мінеральну воду обеззаражують сріблом дозою 0,2мг/м3. Це забезпечує значну економію для заводів.
Дослідження показали, що при зануренні курячих яєць у срібну воду досягається ефективна дезінфекція шкаралупи.
Найширше срібна вода використовується в медицині.
У роки Другої світової війни срібну воду використовували для лікування свищів, виразок, гнійних запалень, опіків. У 60-ті роки XX ст. срібна вода успішно застосовувалася в санаторії «Гарячий ключ» Краснодарського краю для лікування ангін, виразок шлунку, в гінекологічній та стоматологічній практиці [5].
Досліджували властивості срібної води в Київському науково-дослідному інституті педіатрії, акушерства і гінекології під час лікування бактеріальних вульвовагінітів у дітей. Результати були високоефективними.
У лікувальній практиці використання срібної води як антимікробного препарату було виявлено також її вплив на підвищення імунітету людини, зміцнення нервової системи.
Срібною водою забезпечували космонавтів під час польотів.
Нині розроблена технологія консервування води йонами срібла на морських кораблях та аварійних запасів води для рятувальних суден.
Срібна вода зберігається в поліетиленових мішечках, поміщених у герметично закриті банки. Така вода не втрачає своїх смакових і біохімічних властивостей упродовж двох років [1, с.35].
1.3.3. Тала вода
Останнім часом установлено, що свіжа тала вода позитивно впливає на живі організми. Секрет «бурульки» вперше виявлено в Антарктиді, коли під час танення льоду був виявлений інтенсивний розвиток планктону — різновид мілководних організмів.
Свіжа тала вода наділена «пам’яттю». Встановлено, що вона має характерну підвищену біологічну активність, яка зберігається деякий час після танення. Вчені помітили, що свіжо тала вода, яка вільно проходить крізь стінки стравоходу, здійснює оздоровчу та омолоджуючу дії на весь організм. Проте, якщо лід розплавити і талу воду закип’ятити, то вона втрачає стимулюючі властивості [3].
Тала вода підвищує урожайність сільськогосподарських культур, приріст молодняку птиці і тварин, яйценосності курей, молочність корів. Снігове покриття — це природне багатство полів. Незначна теплопровідність снігу захищає поверхню землі і рослинність від негативного впливу сильних морозів та служить джерелом вологи, поповнюючи її запаси за рахунок талих вод.
1.3.4. Активована вода
Активована вода отримується в процесі температурної активації. Суть методу полягає в тому, що обезсолена вода чи водний розчин, унаслідок нагрівання їх до високих температур під високим тиском змінюють свої властивості. Після повернення до звичайних умов така вода перебуває в особливому (метастабільному) стані, що проявляється в підвищеній розчинній здатності сульфідів, силікатів, карбонатів та інших сполук, у здатності тривалий час утримувати в своєму стані аномальні кількості розчиненої речовини і значно підвищувати кислотність.
Експерименти довели, що питома електропровідність активованої обезсоленої води в 10—20 разів вища, ніж неактивованої [5].
Учені сподіваються, що відкриття цього ефекту дасть змогу встановити закономірності утворення запасів корисних копалин та знайти ефективні шляхи їх пошуків.
Проводяться й медичні експерименти з активованою водою. Вона прискорює загоювання ран. Досліджують використання такої води для лікування екземи та алергії [1, с.50].
1.3.5. Магнітна вода
Останнім часом багато пишуть про так звану магнітну воду та про найдивовижніші результати, досягнуті завдяки її застосуванню в різних галузях.
Магнітна обробка води виявилася дуже ефективною для боротьби з накипом. Прискорення процесу кристалізації мінеральних домішок у воді забезпечує зменшення розмірів частинок накип утворюючих солей.
Магнітна вода значно зменшує відкладання органічних речовин, наприклад парафінів. Така обробка корисна під час добування та перекачування високо парафінової нафти.
Омагнічення води успішно застосовують на водопровідних станціях у разі значного помутніння природних вод; аналогічна обробка промислових стоків забезпечує швидке зсідання дрібнодисперсних забруднень.
Здатність магнітної води покращувати змочування твердих поверхонь використовується для вилучення цінних металів із руди під час її збагачення.
Магнітна вода використовується в сільському господарстві. Наприклад, п’ятигодинне замочування зерен буряків у магнітній воді значно підвищує врожайність, полив магнітною водою стимулює ріст і врожайність соняшнику, кукурудзи, помідорів [4].
Зараз широко вивчається використання магнітної води в медицині: вона допомагає виводити ниркові камені, має бактерицидну дію.
В одній із клінік Санкт-Петербурга хворі з нирковою та жовчнокам’яною хворобами пили таку воду і вона сприяла вимиванню солей та невеликих камінців. У клініці медичного інституту м. Пермі успішно використовують магнітне поле як знеболюючий фактор та як засіб, що прискорює рубцювання виразок і ран. [ 1, с.58].
1.3.6 Мертва вода
Нею заповнені моря, річки, озера, що отруєні відходами промисловості та іншої діяльності людини.
Відомий французький океанограф Жак-Ів-Кусто писав: «Наш батько — океан гине. Море стало стічною ямою, куди стікають усі забруднюючі речовини, що виносяться отруєними річками, і всі забруднюючі речовини, які вітер і дощ збирають у нашій отруєній атмосфері. Скидають такий бруд також танкери. Тому не слід дивуватися тому, що потроху з цієї стічної ями зникає життя.
Мені важко сказати, який з океанів найбільше забруднений. Середземне море найбільш забруднене на Землі. Під загрозою життя не лише мешканців моря, а й людей, що мешкають на побережжі» [5].
За підрахунками Морського агентства в моря і океани щорічно скидають понад 6 млн. тонн нафти. Ця нафта — не дар природи. Вона з’являється тут з вини людей. Важко уявити, але 1 г нафти може вкрити 12 км2 поверхні води. А в океан щорічно потрапляє близько 1 % нафти, що транспортується. Вчені підрахували, що якщо в 1л води міститься 0,1 млрд. доля нафтопродуктів, то рибу споживати неможна [4].
XX ст. назване атомним віком. Ми живемо в XXI ст. Радіоактивні відходи продовжують забруднювати водойми. Майже півстоліття тому в мілке Балтійське море були викинуті цементні контейнери, що містили 7 тис. тонн арсену. Нині вони продірявилися. Отрути в них утричі більше, ніж необхідно для того, щоб отруїти все населення Землі. Чим не мертва вода?
Важким уроком для України стала аварія на Чорнобильській АЕС. Адже радіоактивні ізотопи, що потрапляють у воду, практично неможливо знешкодити. Слід знати, що найнебезпечнішим є стронцій-90 і цезій-137, оскільки ці елементи беруть участь у біологічному циклі. Період їх напіврозпаду майже 30 років. Діючи на організм людини і тварин, вони порушують протікання важливих життєвих процесів [ 1, с.63].
Радіоактивні забруднення, викликані випробуванням атомної зброї, швидко поширюються в атмосфері. Постійно випадаючи на поверхню Землі, радіоактивні аерозолі забруднюють і Світовий океан.
Суттєвим фактором забруднення природного середовища є рідкі відходи тваринництва. Кожна тонна цих відходів у середньому містить 9 кг азоту, 2,5 кг калію, 1 кг фосфору.
1.4. Ефект Мпемба
Цей феномен помічали свого часу Арістотель, Френсіс Бекон і Рене Декарт, однак лише в 1963 році танзанійський школяр Ераст Мпемба висунув вердикт, що гаряча суміш морозива замерзає швидше, ніж холодна. Він звернувся за роз’ясненнями до вчителя фізики, але той лише посміявся над учнем, сказавши таке: «Це не всесвітня фізика, а фізика Мпемби». На щастя, одного разу в школі побував Денніс Осборн, професор фізики з університету Дар-ес-Саламу. І Мпемба звернувся до нього з тим же питанням. Професор був налаштований менш скептично, сказав, що він не може судити про те, чого ніколи не бачив, і після повернення додому попросив співробітників провести відповідні експерименти. Схоже, вони підтвердили слова хлопчика. В усякому разі, в 1969 році Осборн розповів про роботу з Мпембою в англійському журналі «Physics Education». У тому ж році Джордж Келл з канадської Національної дослідницької ради опублікував статтю з описом явища в «англ. American Journal of Physics» [12].
З тих пір висловлювалися різні версії, одна з яких звучала наступним чином: частина гарячої води спочатку просто випаровується, а потім, коли залишилося менше її кількість, вода застигає швидше. Ця версія, в силу своєї простоти, стала найпопулярнішою, але вчених не задовольняла в повному обсязі.
Нині команда дослідників з Технологічного університету Наньян в Сінгапурі (Nanyang технологічний університет) на чолі з хіміком Сі Чжаном (Сі Чжан) заявила, що їм вдалося вирішити вікову загадку про те, чому тепла вода застигає швидше, ніж холодна. Як з’ясували китайські фахівці, секрет криється в кількості енергії, запасеної в водневих зв’язках між молекулами води.
Як відомо, молекули води складаються з одного атома кисню і двох атомів водню, утримуваних разом ковалентними зв’язками, що на рівні частинок виглядає як обмін електронами. Інший відомий факт полягає в тому, що атоми водню притягуються до атомам кисню з сусідніх молекул – при цьому утворюються водневі зв’язку.
У цей же час молекули води в цілому відштовхуються одна від одної. Вчені з Сінгапуру помітили: чим тепліше вода, тим більшим виявляється відстань між молекулами рідини через збільшення відразливих сил. В результаті водневі зв’язку розтягуються, а отже, запасають велику енергію. Ця енергія вивільняється при охолодженні води – молекули зближуються один з одним [8]. А віддача енергії, як відомо, і означає охолодження.
РОЗДІЛ 2. ДОСЛІДЖЕННЯ ШВИДКОСТІ НАГРІВАННЯ ВОДИ
2.1.Теплообмін. Основи теорії теплопередачі
Теорія теплообміну разом з термодинамікою входить до складу теоретичних основ теплотехніки і вивчає закономірності перенесення теплоти з одних областей простору в інші.
Теплообмін – це самовільний необоротний процес перенесення теплоти в просторі з неоднорідним розподілом температури.
Існують три різні за своєю природою види теплообміну: теплопровідність, конвективний теплообмін, променевий теплообмін.
Теплопровідність − це вид теплопередачі, при якому відбувається безпосередня передача енергії від частинок (молекул, атомів) більш нагрітої частини тіла до частинкам його менш нагрітої частини.
Конвективний теплообмін – це перенесення теплоти, обумовлене переміщенням макроскопічних елементів середовища (об’ємів рідини або газу) в просторі, що супроводжується тепло провідністю. Його найпоширеніший випадок – тепловіддача – конвективний теплообмін між середовищем, що рухається, і поверхнею поділу її з іншим середовищем (твердим тілом, рідиною або газом) [11].
Тепловий потік – це кількість теплоти що проходить через поверхню за одиницю часу. Розмірність теплового потоку співпадає з розмірністю потужності [16].
Променевий теплообмін – вид теплообміну, обумовлений перетворенням частини внутрішньої енергії тіла в енергію випромінювання. Теплове випромінювання притаманне твердим тілам, рідинам і газам. Його називають ще тепловим випромінюванням
2.2. Експериментальна частина
У своїй роботі ми провели ряд експериментів, які були спрямовані на те, щоб дослідити швидкість нагрівання води залежно від її хімічного складу. Суть експерименту полягала в тому, що ми брали один і той же нагрівник, а у воду додавали різні домішки. І через певні інтервали часу фіксували покази термометра.
Нами була проведена серія експериментів на основі яких ми робили висновки про зміну швидкості нагрівання води.
Ми досліджували значення часу, який необхідний для нагрівання 1 кг. на 1 0С, залежно від хімічного складу води.
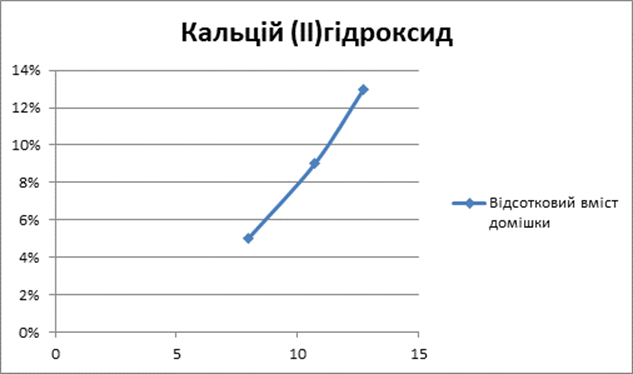
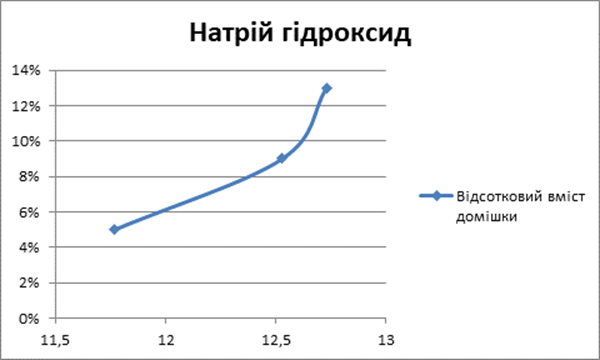
Луги
|
№ експерименту |
Об’єм води |
Тип домішок |
Хімічна формула |
Час нагрівання до 70оC,с |
Час нагрівання 1 кг. на 1оC,с |
Відсотковий вміст домішки |
|
1 |
200мл |
Кальцій (II)гідроксид |
Ca(OH)2 |
117 |
7,96 |
5% |
|
2 |
200мл |
Кальцій (II)гідроксид |
Ca(OH)2 |
165 |
10,71 |
9% |
|
3 |
200мл |
Кальцій (II)гідроксид |
Ca(OH)2 |
205 |
12,73 |
13% |
|
4 |
200мл |
Натрій гідроксид |
NaOH |
173 |
11, 77 |
5% |
|
5 |
200мл |
Натрій гідроксид |
NaOH |
193 |
12,53 |
9% |
|
6 |
200мл |
Натрій гідроксид |
NaOH |
205 |
12,73 |
13% |
Результати в Додатку А.
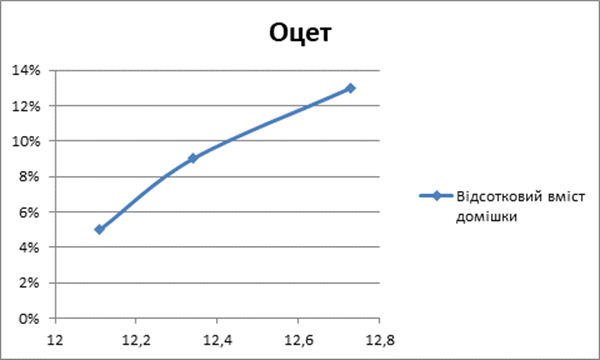
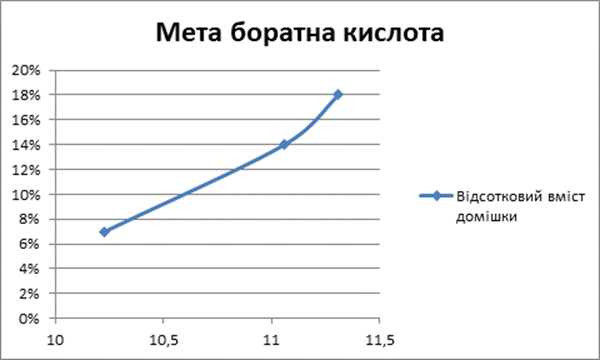
Кислоти
|
№ експерименту |
Об’єм води |
Тип домішок |
Хімічна формула |
Час нагрівання до 70оC, с |
Час нагрівання 1кг. на 1оC, с |
Відсотковий вміст домішка |
|
1 |
200мл |
Оцет |
CH3COOH |
178 |
12,11 |
5% |
|
2 |
200мл |
Оцет |
CH3COOH |
190 |
12,34 |
9% |
|
3 |
200мл |
Оцет |
CH3COOH |
205 |
12,73 |
13% |
|
4 |
200мл |
Мета боратна |
HBO3 |
154 |
10,23 |
7% |
|
5 |
200мл |
Мета боратна |
HBO3 |
178 |
11,06 |
14% |
|
6 |
200мл |
Мета боратна |
HBO3 |
194 |
11,31 |
18% |
Результати можна переглянути в Додатку Б.
Солі
|
№ експерименту |
Об’єм води |
Тип домішок |
Хімічна формула |
Час нагрівання до 70оC, с |
Час нагрівання 1 кг. на 1оC, с |
Відсотковий вміст домішка |
|
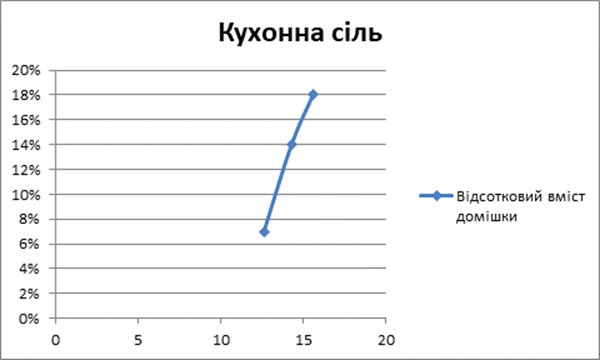
1 |
200мл |
Кухонна сіль |
NaCl |
190 |
12,62 |
7% |
|
2 |
200мл |
Кухонна сіль |
NaCl |
230 |
14,29 |
14% |
|
3 |
200мл |
Кухонна сіль |
NaCl |
250 |
14,58 |
18% |
|
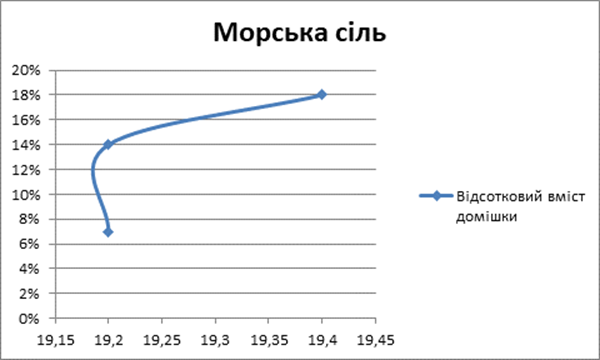
4 |
200мл |
Морська сіль
|
NaCl |
290 |
19,2 |
7% |
|
5 |
200мл |
Морська сіль |
NaCl |
310 |
19,2 |
14% |
|
6 |
200мл |
Морська сіль |
NaCl |
323 |
19,4 |
18% |
Рузультати можна переглянути в Додатку В.
Аналіз даних експериментів, дозволяє стверджувати, що швидкість нагрівання води залежить від її хімічного складу.
Чітко прослідковується взаємозв’язок: наявність кислотних домішок спричиняє збільшення часу необхідне для нагрівання 1 кг. води на 10С [Додаток Б].
Так само і наявність лужного середовища у воді збільшує час нагрівання води [Додаток А].
ВИСНОВКИ
Провівши аналіз наукових, науково-популярних, літературних джерел можна з упевненістю стверджувати, що вода не просто необхідна умова існування життя на нашій планеті, але і найбільша загадка нашої планети. Можна так само з упевненістю говорити, що у дослідженні води людством зроблено дуже і дуже мало, саме тому вивчення різноманітних аномальних властивостей буде актуальним ще не одне десятиліття.
У роботі описано проведену серію експериментів у домашніх умовах які дають можливість стверджувати , що швидкість нагрівання води залежить від її хімічного складу . Чітко прослідковується взаємозв’язок: наявність кислотних домішок спричиняє збільшення часу необхідне для нагрівання 1 кг. води на 10С. Так само наявність лугів у воді збільшує час нагрівання води. Дана залежність є прямо пропорційною.
Встановлено, що зміна температури з часом являє собою експоненціальну залежність, що в свою чергу відкриває можливості для прогнозування поведінки температури з часом.
Можна стверджувати, що завдання, яке ставилося на початку роботи є виконаним.
Дану роботу можна використовувати для проведення факультативних та гурткових занять з фізики, природознавства, хімії.. Також вона може бути цікавою тим, хто почав захоплюватися фізикою.
Результати дослідження можуть мати практичне значення:
- для обрахунку енергоефективності систем опалювання;
- прогнозування часу нагрівання води;
- встановлення необхідної температури в приміщені.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Подолян Т. Позакласні заходи з фізики / Т.Подолян, О.Подолян; [Посібник для вчителів та студентів] // Фізика. – 2005. – № 16/17, червень. – С. 2–96.
- Сафіуліна К.Р. Про енергопостачання та енергозбереження для майбутнього споживача: посібник для курсу за вибором для учнів 6-8 класів / К. Р. Сафіуліна. – К.: ТОВ «Поліграф плюс», 2016. – 312 с.: 178 іл., 48 табл.
ІНТЕРНЕТ-РЕСУРСИ
- http://vchiti.in.ua/ttbdeac/Тема%3A+Вода+–+колиска+життя.+Метаc/part-2.html
- http://fito-center.ru/terapii/vodoterapiya/6760-magnitnaya-voda-izgotovlenie-i-primenenie-magnitnoy-vody
- http://provodu.kiev.ua/voda-znaioma-ta-zagadkova
- http://ua.textreferat.com/referat-254-2.html
- http://vodamama.com/svoystva-vody.html
- http://www.ukrreferat.com/index.php?referat=71004&pg=3
- http://www.vesti.ru/doc.html?id=1150273
- http://zavantag.com/docs/index-12252406.html
- https://uk.wikipedia.org/wiki/Вода
- https://uk.wikipedia.org/wiki/Ефект_Мпемби
- https://uk.wikipedia.org/wiki/Потрійна_точка
- https://uk.wikipedia.org/wiki/Вуглекислі_води
- http://dic.academic.ru/dic.nsf/enc_physics/2544/ТЕПЛОВОЙ
- Властивості води – [Електронний ресурс] – Режим доступу: http://buklib.net/books/36170/
- https://uk.wikipedia.org/wiki/Питома_теплоємність
- http://mpe.kmu.gov.ua/minugol/control/uk/publish/article?art_id=244916068&cat_id=244916056
ДОДАТКИ
Додаток А: Луги
Додаток Б: Кислоти
Додаток В: Солі
Редакція може не поділяти думку авторів і не несе відповідальність за достовірність інформації. Будь-який передрук матеріалів з сайту може здійснюватись лише при наявності активного гіперпосилання на e-kolosok.org, а також на сам матеріал!