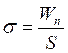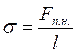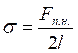Роботу виконав:
Галян Вадим
учень 10 класу
ЗОШ І-ІІІ ступеня с. Любохини
Науковий керівник:
Юхимук Олександр Федорович,
вчитель фізики
ЗОШ І-ІІІ ступеня с. Любохини
Старовижівського району Волинської області,
лауреатка IV Всеукраїнського Інтернет-конкурсу
„УЧИТЕЛЬ РОКУ–2019” за версією
науково-популярного природничого журналу
„КОЛОСОК” у номінації „Фізика і астрономія”
ВСТУП
У навколишньому світі існують сили, дію яких ми відчуваємо щодня – сили тяжіння, пружності і тертя. Але є ще одна сила, на яку ми зазвичай мало звертаємо увагу. Вона порівняно невелика, її робота ніколи не викликає помітних ефектів. Проте ми не можемо налити води або молока в склянку, взагалі нічого не можемо зробити з будь-якою рідиною без того, щоб не привести в дію силу, яка є об’єктом нашого дослідження. Це сила поверхневого натягу. Сила поверхневого натягу – це сила, яка діє уздовж поверхні рідини і викликає зменшення її площі. Ця сила зумовлена взаємним притяганням молекул рідини, спрямована по дотичній до її поверхні. Дія сили поверхневого натягу призводить до того, що рідина в рівновазі має мінімально можливу площу поверхні. При контакті рідини з іншими тілами рідина має поверхню, яка відповідає мінімуму її поверхневої енергії [1].
З поверхневим натягом рідини ми стикаємося щодня: окремі краплі води прагнуть прийняти форму, близьку до кулястої; струмінь води з-під крана набуває циліндричної форми; багато комах можуть ковзати по поверхні води. Будь-хто може згадати багато подібних прикладів з життя.
Поняття поверхневого натягу вперше ввів Янош Андраш Сегнер в 1752 році. У другій половині XIX століття Джозайя Віллард Гіббс розвинув термодинамічну теорію поверхневих явищ, у якій вирішальну роль відіграє поверхневий натяг. У XX столітті були розроблені методи регулювання поверхневого натягу за допомогою поверхнево-активних речовин (ПАР). У 1983 році було доведено теоретично і підтверджено даними з довідників, що поняття поверхневого натягу рідини є частиною поняття внутрішньої енергії. Серед сучасних актуальних проблем – розвиток молекулярної теорії поверхневого натягу різних рідин, включаючи розплавлені метали.
Сили поверхневого натягу відіграють важливу роль в явищах природи, біології, медицині, в різних сучасних технологіях, поліграфії, техніці, в фізіології нашого організму. Тому дуже важливим кроком в науці стало відкриття методів вимірювання коефіцієнта поверхневого натягу рідин.
Актуальність роботи полягає в необхідності вивчення явища поверхневого натягу рідин та проблеми застосування ПАР, які повсякденно використовуються у побуті.
Новизна наукової роботи полягає у дослідженні залежності коефіцієнта поверхневого натягу від температури та ефективності використання ПАР, зокрема деяких видів миючих засобів .
Мета наукової роботи: вивчити явище поверхневого натягу рідин, дослідним шляхом виміряти коефіцієнт поверхневого натягу води і розчинів ПАР, дослідити його залежність від температури.
Мета роботи передбачає вирішення таких завдань:
– вивчити структуру рідини на молекулярному рівні, зрозуміти, чим викликане явище поверхневого натягу;
– виявити найбільш активний миючий засіб , шляхом порівняння коефіцієнта поверхневого натягу;
– дослідити залежність коефіцієнта поверхневого натягу від температури.
Об’єктом дослідження є коефіцієнт поверхневого натягу рідин.
Предмет дослідження – залежність коефіцієнта поверхневого натягу від температури та ефективність ПАР, зокрема деяких видів миючих засобів.
Практичне значення цієї роботи полягає в можливості використання її результатів на уроках фізики, в позаурочній і гуртковій роботі; порівняння коефіцієнта поверхневого натягу для різних миючих засобів буде корисним при їх виборі та дозволить заощадити кошти.
Джерельною базою наукової роботи є матеріали, зібрані членами секції, експериментальні дані, теоретичні підрахунки та дані, взяті з огляду літератури.
Теоретичну базу дослідження становлять наукові праці, які використовувалися під час дослідження, огляд літератури.
1. ТЕОРЕТИЧНА ЧАСТИНА
1.1. Сутність поверхневого натягу
Сама назва «поверхневий натяг» свідчить про те, що це явище виникає на межі поділу середовищ у різних агрегатних станах, а саме: рідкого і газоподібного або рідкого і твердого. Причиною наявності поверхневого натягу є відмінність станів молекул рідини, що знаходяться у товщі рідини та у приповерхневому шарі. Розглянемо це більш детально.
Рідкий стан речовини характеризується тим, що внаслідок міжмолекулярної взаємодії рідина, як і тверде тіло, здатна зберігати свій об’єм. Однак інтенсивність міжмолекулярної взаємодії недостатньо велика для того, щоб утримувати молекули у визначених позиціях. Тому час від часу молекули рідини стрибкоподібно змінюють свої положення. Це є причиною текучості рідин, внаслідок якої форма рідини залежить від зовнішніх чинників [2].
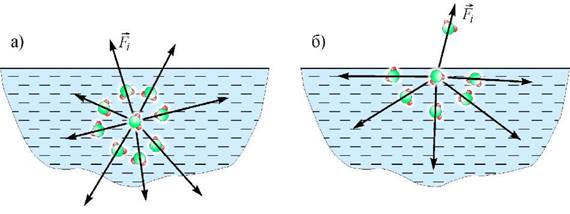
Рис. 1.1. Дія сил міжмолекулярної взаємодії на молекулу у товщі води (а) та у приповерхневому шарі (б)
Зазначені стрибкоподібні переміщення молекул відбуваються хаотично в усіх напрямках. Якщо прослідкувати за будь-якою молекулою, що знаходиться у товщі рідини, то її переміщення у середньому дорівнюватиме нулю (за умови, що рідина у стані спокою). Це означає, що середнє значення сили притягання (або відштовхування), яка діє на одну молекулу у товщі рідини зі сторони інших молекул, також дорівнює нулю (![]() , див. рисунок 1.1. а). Інша ситуація спостерігається для молекул приповерхневого шару. Внаслідок близькості межі поділу середовищ сила притягання зі сторони молекул товщі рідини виявляється у середньому незкомпенсованою зі сторони менш численних молекул приповерхневого шару, молекул пари цієї рідини та інших газів (
, див. рисунок 1.1. а). Інша ситуація спостерігається для молекул приповерхневого шару. Внаслідок близькості межі поділу середовищ сила притягання зі сторони молекул товщі рідини виявляється у середньому незкомпенсованою зі сторони менш численних молекул приповерхневого шару, молекул пари цієї рідини та інших газів (![]() , див. рисунок 1.1. б). При цьому нескомпенсована сила спрямована переважно у товщу рідини. З вище зазначеного випливають наступні наслідки.
, див. рисунок 1.1. б). При цьому нескомпенсована сила спрямована переважно у товщу рідини. З вище зазначеного випливають наступні наслідки.
1) Молекули приповерхневого шару мають тенденцію до переміщення у товщу рідини. Тобто молекули будуть переважно переміщуватися з приповерхневого шару у середину рідини, поки збільшення тиску всередині рідини не зупинить цей процес. Це призводить до того, що площа вільної поверхні рідини є завжди мінімальною за визначених умов. Так, наприклад, якщо на рідину не діють будь-які інші тіла, вона самостійно набуває форми кулі, оскільки саме така форма відповідає мінімальній площі поверхні.
2) Тиск, що створюється внаслідок руху молекул з приповерхневих шарів усередину рідини, називається внутрішнім. За абсолютною величиною він на декілька порядків більший порівняно з тим, що може бути створений зовнішніми чинниками як природного, так і антропогенного характеру. Тому рідини практично не піддаються стисканню.
3) Молекули приповерхневих шарів мають додаткову енергію порівняно з молекулами товщі рідини. Ця енергія називається поверхневою. Величина поверхневої енергії пропорційна до кількості молекул у приповерхневому шарі рідини, а отже, пропорційна площі її поверхні. Коефіцієнт пропорційності залежить від типу рідини і називається коефіцієнтом поверхневого натягу. Ця величина має зміст питомої поверхневої енергії і, як правило, позначається σ:
де Wп – поверхнева енергія; S – площа вільної поверхні рідини, [σ] = Дж/м2. Поруч із густиною та в’язкістю коефіцієнт поверхневого натягу є однією з основних характеристик рідини. Зважаючи на те, що природа поверхневого натягу базується як на міжмолекулярній взаємодії, так і на хаотичних переміщеннях молекул, σ відчутно залежить від температури [3].
З енергетичної точки зору вже зазначений раніше факт, що рідина завжди прагне мінімізувати площу своєї вільної поверхні, є наслідком того, що будь-яка фізична система завжди прямує до стану з мінімальною енергією. У даному випадку мінімум енергії рідини визначається мінімумом площі її вільної поверхні.
Слід зауважити, що роль поверхневого натягу у поведінці рідини залежить від її об’єму. Зі зменшенням об’єму кількість молекул, що знаходяться на поверхні, по відношенню до їх загальної кількості збільшується. Тому зі зменшенням об’єму рідини зростає і ступінь впливу поверхневого натягу. Так, наприклад, вода об’ємом 1 літр в умовах наявності земного тяжіння повністю займає будь-яку посудину з утворенням горизонтальної, практично плоскої межі поділу вода-повітря. У той самий час вода об’ємом близько 50 мм3 за тих самих умов може набувати форми, близької до сферичної (крапля роси). Залежність від об’єму тіла існує не лише для поверхневого натягу, а й для усіх інших поверхневих ефектів.
1.2. Сила поверхневого натягу
Тенденція до зменшення вільної поверхні рідини внаслідок поверхневого натягу зумовлює існування на поверхні рідини певної сили, яка отримала назву сили поверхневого натягу. Поведінка поверхні рідини схожа на поведінку розтягненої пружної плівки, а дія сили поверхневого натягу подібна дії сили пружності, що протидіє розтягу плівки. Тому сила поверхневого натягу завжди спрямована вздовж дотичної до поверхні рідини.
Виведемо формулу для сили і коефіцієнта поверхневого натягу.
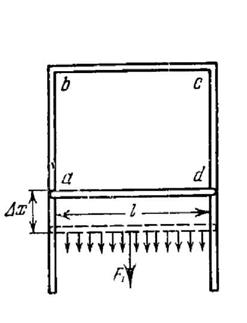
Розглянемо дротяний каркас abсd з рухомим ребром, занурений у мильну воду (рис. 1.2.). Під час витягання каркасу з розчину в ньому залишиться натягнутою тонка мильна плівка. Пересунемо нижнє рухливе ребро на деяку відстань Δх, як це показано пунктиром.
Для рівноваги дротини необхідно, щоб ![]() , де
, де ![]() – сила поверхневого натягу, що діє на ребро з боку однієї з поверхонь плівки. Отже, F1 = 2Fп.н..
– сила поверхневого натягу, що діє на ребро з боку однієї з поверхонь плівки. Отже, F1 = 2Fп.н..
Зовнішня сила виконає роботу
A = F1 Δх = 2Fп.н. Δх (1.2)
Відповідно до закону збереження енергії, ця робота дорівнює зміні поверхневої енергії плівки
A = ΔE = Wп2 – Wп1 = 2σS2 – 2σS1 = 2σ (S2 – S1).
Оскільки S2 – S1 = lΔx, де l – довжина рухомої дротини, то
А = 2σlΔx. (1.3)
Прирівнюючи праві частини виразів (1.2) і (1.3), отримаємо
2Fп.н.Δх = 2σlΔx.
Звідси сила поверхневого натягу, що діє на межу поверхневого шару довжиною l, дорівнює
Fп.н. = σl,
а коефіцієнт поверхневого натягу з отриманої формули
Таким чином, модуль сили поверхневого натягу буде пропорційним довжині контуру на поверхні рідини, а її напрям буде спрямований перпендикулярно до контуру l та паралельно дотичній до її поверхні [4].
1.3. Поверхнево-активні речовини
Поверхнево-активними речовинами (ПАР) називаються хімічні речовини, які зменшують поверхневий натяг рідини. Основною кількісною характеристикою ПАР є поверхнева активність (As) – здатність речовини зменшувати величину σ.
Зауважимо, що за рахунок обмеженої розчинності ПАР існує критична концентрація, за якої подальше додавання ПАР не приводить до зменшення коефіцієнта поверхневого натягу. Особливість будови молекул ПАР полягає у наявності гідрофільних груп, які більш інтенсивно притягуються до молекул рідини, ніж між собою, та гідрофобних груп, що, навпаки, активніше взаємодіють між собою, ніж з молекулами рідини (див. рис. 1.3 а). Зрозуміло, що положення рівноваги для таких молекул має місце, коли молекула знаходиться на поверхні рідини, і при цьому гідрофільна частина знаходиться у рідині, а гідрофобна – на зовні (див. рис. 1.3 б). Молекули рідини у приповерхневому шарі виявляються розділеними молекулами ПАР, в результаті чого інтенсивність міжмолекулярної взаємодії у приповерхневому шарі зменшується. Як наслідок, поверхнева енергія також зменшується, що призводить до зменшення коефіцієнта поверхневого натягу рідини.
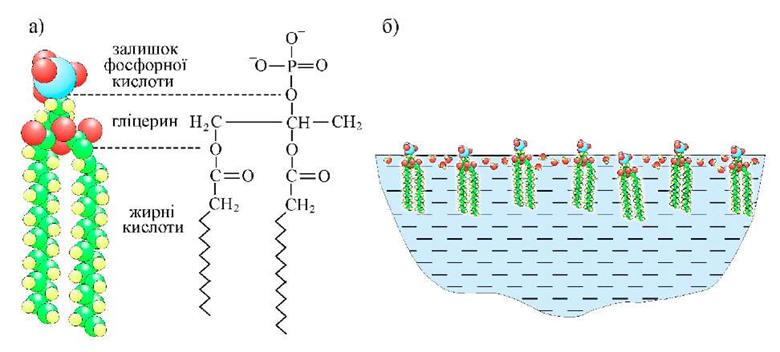
Рис. 1.3. Приклад схематичної будови молекули ПАР – фосфоліпіду (а). До пояснення поведінки молекул ПАР у рідині (б).
Прикладом ПАР є звичайне мило (суміш натрієвих солей жирних карбонових кислот – олеату (С17Н33СООNa) та стеарату (С17Н35СООNa) натрію), а також спирти, карбонові кислоти.
1.4. Класифікація ПАР
Існує надзвичайно велика кількість ПАР, які значно відрізняються між собою за фізико-хімічними характеристиками. Також існує декілька класифікацій таких речовин. Так, у відповідності до класифікації, прийнятої Міжнародною Організцією зі стандартизації (International Organization for Standardization – ISO), ПАР за хімічними властивостями поділяють на чотири типи.
1) Аніонні ПАР. Вони містять в молекулі одну чи декілька полярних груп та добре дисоціюють у воді з утворенням аніонів у вигляді довгих ланцюжків, які і визначають їх поверхневу активність.
2) Катіонні ПАР, молекули яких під час дисоціації утворюють поверхневоактивний катіон з довгим гідрофобним ланцюжком аніона – як правило галогеніду. Катіонактивні ПАР менше знижують поверхневий натяг, ніж аніонактивні, однак можуть брати участь у хімічних реакціях з поверхнею адсорбенту (твердого тіла, здатного накопичувати у собі інші хімічні сполуки).
3) Неіоногенні ПАР не дисоціюють у воді на іони. їх розчинність зумовлена наявністю в молекулах гідрофільних ефірних та гідроксильних груп. Під час розчинення молекули води за допомогою водневого зв’язку приєднується до кисню ефірних та гідроксильних груп. Подібні з’єднання називаються гідратами. Характерною особливістю неіоногенних ПАР є рідкий стан та низьке піноутворення у водних розчинах.
4) Амфотерні ПАР. Даний тип речовин не дисоціює під час розчинення, однак самі по собі вони є хімічно активними. Остання властивість забезпечується, як правило, гідрофільним радикалом та здатністю гідрофобної частини бути акцептором або донором протона.
3 точки зору фізичних властивостей, актуальних для практичного застосування, розрізняють також чотири типи ПАР.
1) Низькомолекулярні ПАР, які добре розчинні у воді, а їх розчин має порівняно малу в’язкість. їх розчини не створюють колоїдних частинок ні в об’ємі, ні в поверхневому шарі, що перешкоджає піноутворенню. Тому такі речовини використовуються як своєрідні «піногасники» у технологічних процесах, де утворення піни є небажаним. Також такі ПАР застосовуються у різних методах сепарації дрібних твердих частинок та виділення крапель дисперсної (розпорошеної, розділеної на багато частинок) фази з емульсій (дисперсних систем, в яких маленькі краплинки однієї рідини знаходяться у об’ємі іншої), в яких використовується різна змочуваність частинок і їх здатність накопичуватися на поверхні поділу фаз – так звана флотація.
2) ПАР, які проявляють поверхневу активність на межі двох рідин, що не змішуються. Зменшення поверхневої енергії завдяки таким ПАР полегшує процес утворення нової поверхні, зокрема в процесі диспергування (механічне розпорошення, утворення дрібних частинок (об’ємів) з великих). Тому вони застосовуються при створенні емульсій, суспензій (дисперсних систем, в яких маленькі частинки твердого тіла знаходяться у об’ємі рідини), аерозолів (дисперсних систем, в яких маленькі частинки рідини або твердого тіла знаходяться у об’ємі газу).
3) Третій тип складають ПАР, молекули яких добре взаємодіють із молекулами рідини, які внаслідок змочування приєднуються до поверхні твердого тіла. В результаті поверхня твердого тіла покривається своєрідною оболонкою із молекул ПАР, при цьому зовнішня частина такої оболонки утворена гідрофобними частинами молекул. Це запобігає об’єднанню диспергованих частинок твердого тіла у більш великі утворення завдяки взаємодії з молекулами рідини – так званої коагуляції. Тому такі ПАР ще називають стабілізаторами.
4) Четвертий тип ПАР складають миючі речовини, або детергенти, що займають перше місце за масштабами практичного застосування. Так, у світі зараз виробляється близько 3 кг миючих засобів на душу населення за рік, а в Україні рівень їх споживання наближається до 5 кг на душу населення за рік. Як і для ПАР попереднього типу, молекули детергенту приєднуються гідрофільними частинами до частинок бруду, а завдяки утвореній гідрофобній оболонці виштовхуються з води та концентруються у стабілізованих частинках емульсії або суспензії. Детергенти повинні мати весь комплекс властивостей, характерних для трьох попередніх типів, тобто суттєво знижувати поверхневий натяг, проявляти змочувальну, гідрофілізуючу дію і бути не тільки диспергаторами, але і сильними стабілізаторами емульсій і суспензій. Також бажаним є стійкість піни, за рахунок якої збільшується активна площа розчину детергенту [5].
1.5. Вплив ПАР на екологію
Більшість ПАР мають надзвичайно широкий діапазон негативного впливу на навколишнє середовище. Молекули ПАР мають здатність накопичуватися на різних поверхнях, поширюються течією і вітром на значні відстані, потрапляють у воду, рослини, фрукти, овочі, ягоди, а потім і в наші організми.
Токсичність ПАР у значній мірі зменшується за рахунок їх здатності до біологічного розпаду.
Враховуючи вище сказане, можна зробити висновок, що людина та навколишнє середовище постійно піддаються дії ПАР. Найбезпечнішими з усіх класів ПАР – неіоногенні. Вони менш токсичні, і більш того, зменшують ступінь залишку інших ПАР на тканинах, шкірі та інших поверхнях.
Оскільки життя практично усіх високорозвинених організмів базується на використанні води, негативна дія ПАР невід’ємно пов’язана із призначенням цих речовин. Зменшення коефіцієнта поверхневого натягу суттєво впливає на капілярні явища, які визначають процеси обміну речовин.
Накопичення ПАР як у прісних водоймах, так і у океані має наслідком зниження поверхневого натягу води. У свою чергу, це зменшує здатність води утримувати кисень та вуглекислий газ, що розчинені у ній, і негативно позначається на умовах існування водної флори та фауни.
Більшість ПАР є синтетичними речовинами, що досить повільно розпадаються і тому здатні накопичуватися в організмах в неприпустимих концентраціях. Крім того, це стосується і продуктів їх розпаду.
Практично всі ПАР, що використовуються у промисловості та побуті, добре адсорбуються на поверхні частинок ґрунту, піску та глини. За певних умов адсорбовані молекули ПАР можуть вивільняти йони важких металів, які утримуються цими частинками, що підвищує ризик їх потрапляння у живі організми [6].
2. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
2.1. Визначення коефіцієнта поверхневого натягу рідин
Існує багато методів визначення коефіцієнта поверхневого натягу рідин. Деякі з них зручніше використовувати на виробництві, інші в лабораторії. Одним з найбільш простих і доступних вважається метод визначення поверхневого натягу за допомогою динамометра типу ДПН (Додаток А).
Обладнання:
1) Динамометр ДПН;
2) Штатив з муфтою і лапкою;
2) Пінцет;
3) Чашка;
4) Мірний циліндр;
5) Шприц;
6) Чиста вода, миючі засоби: Sarma, Gala, Fairy.
Опис експерименту
Принцип визначення коефіцієнта поверхневого натягу базується на такому явищі. Якщо вертикально занурити у рідину рамку (або частину рамки, так звану петлю) з тонкого металевого дроту, який змочується рідиною, а потім обережно витягти її, то у площині рамки утвориться тонка плівка рідини (див. рис. 2.1). При цьому на горизонтальну частину петлі вертикально вниз діятиме сила поверхневого натягу, яка визначатися як Fп.н.= 2σl. Тут l – довжина горизонтальної частини петлі, а множник 2 означає, що у плівки дві поверхні. Для того щоб відірвати петлю від рідини, потрібно прикласти зовнішню силу, яка за модулем має дорівнювати Fп.н..
Зовнішньою силою може служити сила пружності пружини динамометра, що одночасно забезпечує вимірювання величини сили та компенсацію сили тяжіння відповідним встановленням нуля динамометра. Тоді коефіцієнт поверхневого натягу визначається виразом
де Fп.н., – сила поверхневого натягу, тобто показання динамометра у момент відриву петлі [7].
Схема експериментальної установки наведена на рисунку 2.2.
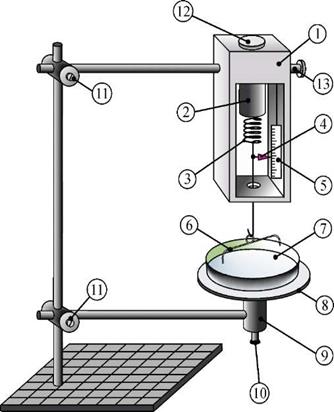
Рис. 2.2. Схематичне зображення експериментальної установки: 1 – корпус динамометра; 2 – стакан динамометра; 3 – вимірювальна пружина; 4 – стрілка для визначення сили; 5 – шкала динамометра; 6 – петля; 7 – чашка для рідини; 8 – підставка; 9 – корпус тримача; 10 – гвинт тримача; 11 – затискачі з гвинтами; 12 – регулювальний гвинт для встановлення нуля; 13 – стопорний гвинт
Порядок виконання експерименту
- Уважно ознайомлюємося з теоретичним матеріалом та будовою установки.
- Установлюємо корпус динамометра 1 вертикально. Корпус тримача 9 встановлюємо так, щоб його вісь збігалася з віссю стакана 2 та пружини 3.
- Висоту підставки 8 встановлюємо так, щоб петля могла занурюватися у рідину та виходити з неї за допомогою гвинта 10.
- Наливаємо у чашку 7 чисту воду.
- Установлюємо чашку з рідиною на підставку 8.
- За допомогою пінцета підвішуємо одну з петель до гачка в нижній частині пружини 3. Довжину горизонтальної сторони петлі записуємо у таблицю 1.
- За допомогою гвинта 12 встановлюємо стрілку динамометра 4 на нульову позначку шкали 5.
- За допомогою гвинта 10 піднімаємо підставку 8 так, щоб петля повністю занурилася у рідину.
- Повільно обертаючи гвинт 10, забезпечуємо повільний та рівномірний по усій довжині l вихід петлі з рідини з утворенням плівки, як це показано на рисунку 2.1. Показання динамометра при цьому будуть рівномірно збільшуватися аж до відриву петлі від рідини.
- У момент відриву фіксуємо покази динамометра та записуємо їх у таблицю 2.1.
- Повторюємо зазначені у пунктах 7 – 10 вимірювання ще 2 рази для тієї самої петлі. Результати записуємо у таблицю 2.1.
- Повторюємо зазначені у пунктах 6 – 10 вимірювання для решти петель. Результати записуємо у таблицю 2.1.
- Обчислюємо середнє значення сили поверхневого натягу для кожної петлі. Результат записуємо у таблицю 2.1.
- Обчислюємо коефіцієнт поверхневого натягу для кожної петлі за формулою 2.1. Результат записуємо у таблицю 2.1.
- Виконуємо дії, зазначені у пунктах 6 – 14 для розчинів ПАР (миючі засоби торгових марок Sarma, Gala, Fairy). Результати записуємо у таблицю 2.1.
Таблиця 2.1
Коефіцієнт поверхневого натягу рідин (при 20 оС)
|
Речовина |
l, мм |
Fп.н., мН |
Fп.н.ср, мН |
σ, мН/м |
σср, мН/м |
|
Чиста вода |
30 |
4,4 |
4,37 |
72,8 |
72,2 |
|
4,3 |
|||||
|
4,25 |
|||||
|
40 |
5,7 |
5,77 |
72,1 |
||
|
5,8 |
|||||
|
5,8 |
|||||
|
50 |
6,95 |
7,17 |
71,7 |
||
|
7,3 |
|||||
|
7,25 |
|||||
|
Розчин Sarma |
30 |
1,5 |
1,57 |
26,7 |
28,2 |
|
1,6 |
|||||
|
1,6 |
|||||
|
40 |
2,1 |
2,2 |
27,5 |
||
|
2,2 |
|||||
|
2,3 |
|||||
|
50 |
3,1 |
3,05 |
30,5 |
||
|
3,0 |
|||||
|
3,05 |
|||||
|
Розчин Gala |
30 |
1,4 |
1,43 |
23,8 |
25,0 |
|
1,5 |
|||||
|
1,4 |
|||||
|
40 |
2,0 |
2,02 |
25,3 |
||
|
2,1 |
|||||
|
1,95 |
|||||
|
50 |
2,6 |
2,6 |
26,0 |
||
|
2,7 |
|||||
|
2,5 |
|||||
|
Розчин Fairy |
30 |
1,2 |
1,3 |
21,7 |
23,8 |
|
1,4 |
|||||
|
1,3 |
|||||
|
40 |
1,95 |
1,95 |
24,4 |
||
|
2,0 |
|||||
|
1,9 |
|||||
|
50 |
2,6 |
2,53 |
25,3 |
||
|
2,5 |
|||||
|
2,5 |
2.2. Дослідження залежності коефіцієнта поверхневого натягу від температури
Дослідимо залежність коефіцієнта поверхневого натягу від темперутури водних розчинів поверхнево-активних речовин. Дослідження проведемо для чистої води і розчинів миючих засобів торгових марок Sarma, Gala, Fairy.
Обладнання:
1) Динамометр ДПН;
2) Штатив з муфтою і лапкою;
2) Пінцет;
3) Чашка;
4) Мірний циліндр;
5) Шприц;
6) Термометр;
7) Електрочайник;
8) Чиста вода, миючі засоби: Sarma, Gala, Fairy.
Порядок виконання експерименту
- Уважно ознайомлюємося з теоретичним матеріалом та будовою установки (рис. 2.2).
- Установлюємо корпус динамометра 1 вертикально. Корпус тримача 9 встановлюємо так, щоб його вісь збігалася з віссю стакана 2 та пружини 3.
- Висоту підставки 8 встановлюємо так, щоб петля могла занурюватися у рідину та виходити з неї за допомогою гвинта 10.
- Наливаємо у чашку 7 чисту воду за температури 20 оС.
- Установлюємо чашку з рідиною на підставку 8.
- За допомогою пінцета підвішуємо одну з петель до гачка в нижній частині пружини 3. Довжину горизонтальної сторони петлі записуємо у таблицю 1.
- За допомогою гвинта 12 встановлюємо стрілку динамометра 4 на нульову позначку шкали 5.
- За допомогою гвинта 10 піднімаємо підставку 8 так, щоб петля повністю занурилася у рідину.
- Повільно обертаючи гвинт 10, забезпечуємо повільний та рівномірний по усій довжині l вихід петлі з рідини з утворенням плівки, як це показано на рисунку 2.1. Показання динамометра при цьому будуть рівномірно збільшуватися аж до відриву петлі від рідини.
- У момент відриву зафіксовуємо показання динамометра.
- Повторюємо зазначені у пунктах 7 – 10 вимірювання ще 2 рази для тієї самої петлі.
- Повторюємо зазначені у пунктах 6 – 10 вимірювання для решти петель.
- Обчислюємо середнє значення сили поверхневого натягу для кожної петлі.
- Обчислюємо коефіцієнт поверхневого натягу для кожної петлі за формулою 2.1. Результати записуємо у таблицю 2.2.
- Виконуємо дії, зазначені у пунктах 6 – 14 для температур 30 оС і 40 оС. Результати записуємо у таблицю 2.2.
- Виконуємо дії, зазначені у пунктах 6 – 15 для розчину миючого засобу торгової марки Sarma). Результат записуємо у таблицю 2.3.
- Виконуємо дії, зазначені у пунктах 6 – 15 для розчину миючого засобу торгової марки Gala). Результат записуємо у таблицю 2.4.
- Виконуємо дії, зазначені у пунктах 6 – 15 для розчину миючого засобу торгової марки Fairy). Результат записуємо у таблицю 2.5.
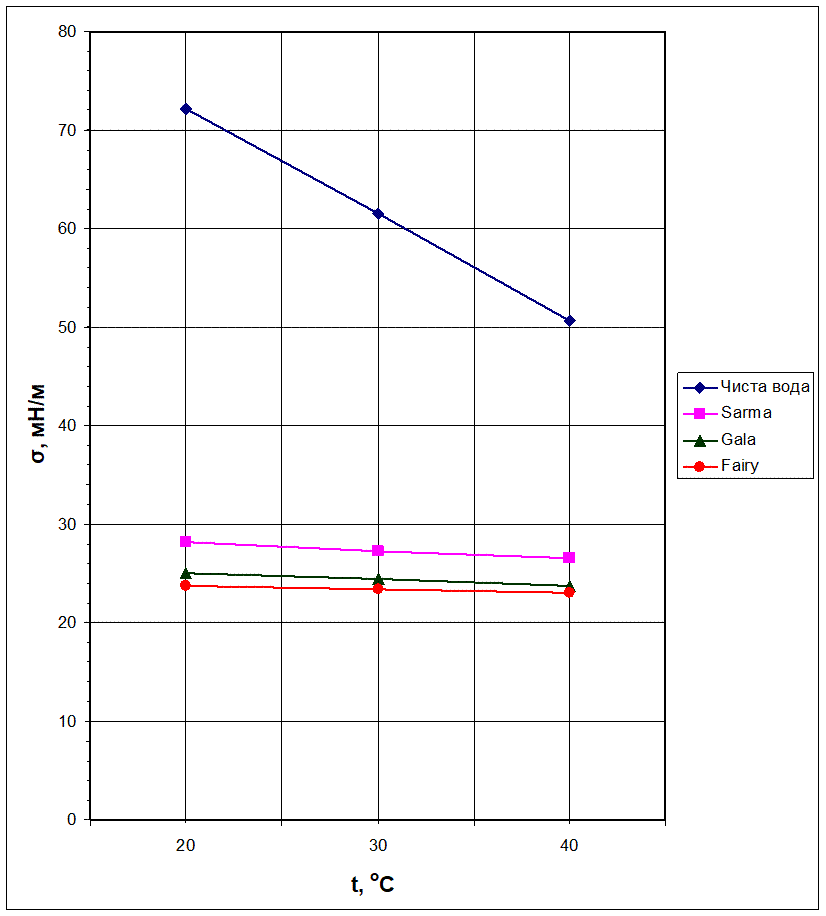
- Будуємо графіки залежності коефіцієнта поверхневого натягу від температури (Рис. 2.3).
Таблиця 2.2
Залежність коефіцієнта поверхневого натягу від температури для чистої води
|
t, оC |
l,мм |
Fп.н., мН |
Fп.н.ср, мН |
σ, мН/м |
σср, мН/м |
|
20 |
30 |
4,4 |
4,37 |
72,8 |
72,2 |
|
4,3 |
|||||
|
4,25 |
|||||
|
40 |
5,7 |
5,77 |
72,1 |
||
|
5,8 |
|||||
|
5,8 |
|||||
|
50 |
6,95 |
7,17 |
71,7 |
||
|
7,3 |
|||||
|
7,25 |
|||||
|
30 |
30 |
3,7 |
3,73 |
62,2 |
61,5 |
|
3,8 |
|||||
|
3,7 |
|||||
|
40 |
4,8 |
4,87 |
60,9 |
||
|
4,9 |
|||||
|
4,9 |
|||||
|
50 |
6,2 |
6,15 |
61,5 |
||
|
6,15 |
|||||
|
6,1 |
|||||
|
40 |
30 |
3,1 |
3,1 |
51,7 |
50,7 |
|
3,0 |
|||||
|
3,2 |
|||||
|
40 |
4,0 |
4,03 |
50,4 |
||
|
4,2 |
|||||
|
3,9 |
|||||
|
50 |
4,9 |
5,0 |
50,0 |
||
|
5,1 |
|||||
|
5,0 |
Таблиця 2.3
Залежність коефіцієнта поверхневого натягу від температури для розчину миючого засобу Sarma
|
t, оC |
l,мм |
Fп.н., мН |
Fп.н.ср, мН |
σ, мН/м |
σср, мН/м |
|
20 |
30 |
1,5 |
1,57 |
26,7 |
28,2 |
|
1,6 |
|||||
|
1,6 |
|||||
|
40 |
2,1 |
2,2 |
27,5 |
||
|
2,2 |
|||||
|
2,3 |
|||||
|
50 |
3,1 |
3,05 |
30,5 |
||
|
3,0 |
|||||
|
3,05 |
|||||
|
30 |
30 |
1,6 |
1,55 |
25,8 |
27,3 |
|
1,55 |
|||||
|
1,5 |
|||||
|
40 |
2,2 |
2,2 |
27,5 |
||
|
2,1 |
|||||
|
2,3 |
|||||
|
50 |
2,8 |
2,85 |
28,5 |
||
|
2,9 |
|||||
|
2,85 |
|||||
|
40 |
30 |
1,5 |
1,45 |
24,2 |
26,5 |
|
1,45 |
|||||
|
1,4 |
|||||
|
40 |
2,2 |
2,1 |
26,3 |
||
|
2,1 |
|||||
|
2,3 |
|||||
|
50 |
3,0 |
2,9 |
29,0 |
||
|
2,9 |
|||||
|
2,8 |
Таблиця 2.4
Залежність коефіцієнта поверхневого натягу від температури для розчину миючого засобу Gala
|
t, оC |
l,мм |
Fп.н., мН |
Fп.н.ср, мН |
σ, мН/м |
σср, мН/м |
|
20 |
30 |
1,4 |
1,43 |
23,8 |
25,0 |
|
1,5 |
|||||
|
1,4 |
|||||
|
40 |
2,0 |
2,02 |
25,3 |
||
|
2,1 |
|||||
|
1,95 |
|||||
|
50 |
2,6 |
2,6 |
26,0 |
||
|
2,7 |
|||||
|
2,5 |
|||||
|
30 |
30 |
1,5 |
1,47 |
24,5 |
24,4 |
|
1,5 |
|||||
|
1,4 |
|||||
|
40 |
2,1 |
2,0 |
25,1 |
||
|
2,2 |
|||||
|
2,0 |
|||||
|
50 |
2,4 |
2,35 |
23,5 |
||
|
2,3 |
|||||
|
2,35 |
|||||
|
40 |
30 |
1,4 |
1,3 |
21,7 |
23,7 |
|
1,3 |
|||||
|
1,2 |
|||||
|
40 |
2,0 |
1,95 |
24,4 |
||
|
1,95 |
|||||
|
1,9 |
|||||
|
50 |
2,6 |
2,5 |
25,0 |
||
|
2,4 |
|||||
|
2,5 |
Табиця 2.5
Залежність коефіцієнта поверхневого натягу від температури для розчину миючого засобу Fairy
|
t, оC |
l,мм |
Fп.н., мН |
Fп.н.ср, мН |
σ, мН/м |
σср, мН/м |
|
20 |
30 |
1,2 |
1,3 |
21,7 |
23,8 |
|
1,4 |
|||||
|
1,3 |
|||||
|
40 |
1,95 |
1,95 |
24,4 |
||
|
2,0 |
|||||
|
1,9 |
|||||
|
50 |
2,6 |
2,53 |
25,3 |
||
|
2,5 |
|||||
|
2,5 |
|||||
|
30 |
30 |
1,3 |
1,35 |
22,5 |
23,4 |
|
1,35 |
|||||
|
1,4 |
|||||
|
40 |
1,95 |
1,88 |
23,5 |
||
|
1,9 |
|||||
|
1,8 |
|||||
|
50 |
2,4 |
2,43 |
24,3 |
||
|
2,5 |
|||||
|
2,4 |
|||||
|
40 |
30 |
1,3 |
1,25 |
20,8 |
23,0 |
|
1,25 |
|||||
|
1,2 |
|||||
|
40 |
2,0 |
1,9 |
23,8 |
||
|
1,8 |
|||||
|
1,9 |
|||||
|
50 |
2,4 |
2,45 |
24,5 |
||
|
2,45 |
|||||
|
2,5 |
ВИСНОВОК
У результаті проведеного дослідження ми з’ясували, що внаслідок того, що молекули поверхні рідини мають надлишок потенціальної енергії у порівнянні з енергією, яку мали б ці молекули, перебуваючи всередині рідини, з’являються сили, які діють уздовж поверхні рідини перпендикулярно лінії, що обмежує цю поверхню, і які прагнуть скоротити її до мінімуму.
Ми змогли вивести формулу для визначення сили поверхневого натягу рідини, коефіцієнтом пропорційності в якій є σ – коефіцієнт поверхневого натягу.
Познайомившись з різними методами визначення коефіцієнта поверхневого натягу і вибравши серед них найбільш доступний, ми самостійно виміряли σ чистої води, водних розчинів миючих засобів торгових марок Sarma, Gala, Fairy і отримали такі результати: для чистої води σ = 72,2 мН/м, для Sarma σ = 28,2 мН/м, для Gala σ = 25,0 мН/м, для Fairy σ = 23,8 мН/м. Проаналізувавши результати експерименту, було встановлено, що найменший коефіцієнт поверхневого натягу має Fairy, тому більш доцільно використовувати в побуті саме цей засіб.
Також у даній науковій роботі ми дослідили залежність коефіцієнта поверхневого натягу від температури для чистої води і водних розчинів миючих засобів торгових марок Sarma, Gala, Fairy, а також побудували графіки цих залежностей. При збільшенні температури поверхневий натяг рідин зменшується. Швидкість зменшення коефіцієнта поверхневого натягу при зростанні температури не однакова. В інтервалі температур від 20 оС до 40 оС σ для Fairy зменшився на величину 0,8 мН/м, для Gala – на 1,3 мН/м, для Sarma – на 1,7 мН/м, а для чистої води – на 21,5 мН/м. Проаналізувавши дані експерименту і побудувавши графіки було встановлено, що найменше коефіцієнт поверхневого натягу змінюється у розчинів миючих засобів, а найбільша зміна відбувається у чистої води.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- «Дослідницькі завдання, як елемент самостійної роботи з фізики». – [Електронний ресурс]. – Режим доступу: cuspu.edu.ua.
- «Будова рідин. Поверхневий натяг». – [Електронний ресурс]. – Режим доступу: edu.vn.ua.
- Фізика: 10 кл.: підруч. для загальноосвіт. навч. закл.: рівень стандарту / Є.В. Коршак, О.І. Ляшенко, В.Ф. Савченко. – К.: Генеза, 2010.
- Фізика (рівень стандарту, за навчальною програмою авторського колективу під керівництвом Локтєва В. М.) : підруч. для 10 кл. закл. загал. серед. освіти / [В.Г. Бар’яхтар, С.О. Довгий, Ф.Я. Божинова, О.О. Кірюхіна] ; за ред. В.Г. Бар’яхтара, С.О. Довгого. — Харків : Вид-во «Ранок», 2018.
- «Класифікація ПАР». – [Електронний ресурс]. – Режим доступу: wikipedia.org/wiki/Поверхнево-активні_речовини.
- «Мити ПАРом чи водою». – [Електронний ресурс]. – Режим доступу: https://ecoclubua.com/2011/08/myty-parom-chy-vodoyu.
- Т. В. Лютий, О. С. Денисова. «Дослідження коефіцієнта поверхневого натягу рідини і впливу на нього поверхнево-активних речовин». – [Електронний ресурс]. – Режим доступу: essuir.sumdu.edu.ua.
ДОДАТКИ
Додаток А
Динамометр для вимірювання сили поверхневого натягу рідини
Динамометр ДПН призначений для демонстрації і непрямих вимірювань коефіцієнта поверхневого натягу рідини в лабораторних умовах при температурі оточуючого повітря від +10 оС до +35 оС і відносній вологості повітря від 80 % при температурі +25оС. Динамометр вимірює силу від 0 до 10 мН з похибкою 0,5 мН. Ціна поділки шкали приладу – 0,5 мН.
Редакція може не поділяти думку авторів і не несе відповідальність за достовірність інформації. Будь-який передрук матеріалів з сайту може здійснюватись лише при наявності активного гіперпосилання на e-kolosok.org, а також на сам матеріал!