Роботу виконав:
Сіробаба Захар Сергійович,
учень 8 – А класу
Лебединської спеціалізованої
школи І-ІІІ ступенів № 7
Лебединської міської ради
Сумської області
Науковий керівник:
Алхімова Олена Олегівна
учителька хімії,
Лебединської спеціалізованої
школи І-ІІІ ступенів № 7
Лебединської міської ради
Сумської області
лауреатка IV Всеукраїнського Інтернет-конкурсу
„УЧИТЕЛЬ РОКУ–2019” за версією
науково-популярного природничого журналу
„КОЛОСОК” у номінації „ХІМІЯ”
Вступ
Актуальність теми. Можливості хімії як науки надзвичайно великі, проте свої перші кроки вона починала з дослідження природних речовин.
Властивості рослинних об’єктів можуть бути використані для застосування в різних галузях науки, таких як хімія, біологія і медицина у якості досліджуваних обєктів можуть бути наприклад, індикатори. Отримання індикаторів з рослинної сировини є набагато доступнішим, ніж використання дорогих синтетичних кислотно-основних індикаторів, особливо на уроках хімії. Вивчення індикаторів дає можливість зробити висновки про необхідність їх використання в хімії, а також важливість їх правильного застосування у якісному аналізі.
Мета науково-дослідницької роботи: отримати рослинні індикатори з природної сировини; вивчити зміни забарвлення рослинних індикаторів в нейтральному, кислому та лужному середовищах; дослідити властивості рослинних індикаторів і використання їх на практиці.
Об’єкт дослідження: рослини, соки яких мають індикаторні властивості.
Предметом дослідження: є рослинні пігменти – антоціани.
Завдання роботи:
- Проаналізувати літературні джерела.
- Визначити рослинні пігменти, які можуть бути використані в якості кислотно-основних індикаторів.
- Виділити пігменти із свіжої та сухої рослинної сировини та на їх основі виготовити індикатори.
- Експериментально отримати набір індикаторів та визначити реакцію рослинних індикаторів в різних середовищах
Методи дослідження:
- Якісний аналіз
- Метод порівняння.
Практичне значення роботи. Головними відмінностями від синтетичних індикаторів є те, що вони не мають чітких меж переходу, колір змінюється поступово, проходячи через проміжні фази. Найбільшу ефективність показав екстракт з червонокачанної капусти.
Властивості індикатору з червонокачанної капусти можна порівняти з властивостями універсального індикаторного паперу.
Отримані індикатори можна використовувати на уроках хімії, аби учні мали уявлення про природні індикатори і мали практичне застосування їх житті в майбутньому (для визначення рН різних розчинів, наприклад, молочних продуктів, а також для визначення кислотності ґрунту, так як на одній і тій же ґрунті в залежності від її кислотності один вид рослин може давати високий урожай, а інші будуть пригнобленими), так як синтетичні індикатори не всім доступні.
Роботу з природними індикаторами можна продовжити, досліджуючи індикаторні властивості багатьох інших рослин.
Робота складається із вступу, трьох розділів, висновків, списку використаних джерел. Містить 24 сторінки, 22 літературних джерела.
Розділ 1. Літературний огляд
1.1. Індикатори
Індикатори (від лат. Indicator – покажчик) – хімічні речовини, що змінюють забарвлення, люмінесценцію або утворюють осад при зміні концентрації компонента в розчині [2].
З допомогою індикаторів якісно визначають реакцію середовища. Вперше індикатори виявив у ХVІІ ст. англійський хімік і фізик Роберт Бойль.
Саме індикатори допомогли вченому відкрити нову кислоту – фосфорну, яку він отримав при спалюванні фосфору і розчиненні білого продукту, що утворився у воді. В наш час широко застосовують наступні індикатори: лакмус, фенолфталеїн, метиловий оранжевий.
Одним з давно відомих індикаторів є лакмус. Хоча лакмус уже протягом багатьох століть, вірно служить людям, його склад до кінця і не вивчений. Лакмус – це складна суміш природних сполук. Він був відомим уже в Давньому Єгипті і в Давньому Римі, де його використовували в якості фіолетової фарби – замінника дорогоцінного пурпуру. Потім рецепт приготування лакмусу був загубленим. Лише на початку ХІVст. У Флоренції знову була відкрита фіолетова фарба орсейль, тотожна лакмусу, причому спосіб її приготування протягом багатьох років тримали в секреті.
Готували лакмус із спеціальних видів лишайників. Подрібнені лишайники зволожували, а потім додавали у цю суміш золу і соду. Приготовану таким чином густу масу поміщали в дерев’яні бочки, додавали сечу і витримували довгий час. Поступово розчин набував темно-синього кольору. Його упарювали і в такому вигляді застосовували для забарвлення тканин. В ХVІІ ст. виробництво орсейлі було налагоджено у Франції і Голландії, а в якості сировини використовували лишайники, які привозили з Канарських островів.
Схоже, на орсейль зафарбовуюча речовина була виділена в ХVІІ ст. з геліотропу – духмяної садової рослини з темно-ліловими квітками. Саме з цього часу, завдяки Р. Бойлю, орсейль і геліотроп стали використовувати в хімічній лабораторії. І лише в 1704 році німецький вчений М. Валентин назвав цю фарбу лакмусом.
Сьогодні для виробництва лакмусу подрібнені лишайники збрижають в розчинах поташу(калій карбонату) і амоніаку, потім в отриману суміш додають крейду і гіпс.
В ХІХ ст. на заміну лакмусу прийшли більш стійкі і дешеві синтетичні барвники, тому використання лакмусу обмежується грубим визначенням кислотності середовища. На зміну лакмусу в аналітичній хімії прийшов лакмоїд – барвник резорциновий синій, який відрізняється від природного лакмусу і за будовою, але схожий з ним за забарвленням: в кислому середовищі він червоний, а в лужному – синій [1; 8].
В наші дні відомі декілька сотень кислотно-основних індикаторів, штучно синтезованих починаючи з середини ХІХ ст. Індикатор метиловий оранжевий в кислому середовищі червоний, в нейтральному – оранжевий, а в лужному – синій [6].
Більш яскрава кольорова гама властива індикатору тимоловому синьому:в кислому середовищі він малиново-червоний, в нейтральному – жовтий, а в лужному – синій.
Індикатор фенолфталеїн(в медицині його раніше називали пургеном, зараз він рідко застосовується в якості проносного) в кислому і нейтральному середовищі – безбарвний, а в лужному має малинове забарвлення. Тому фенолфталеїн використовують лише для визначення лужного середовища.
В залежності від кислотності середовища змінює забарвлення і барвник діамантовий зелений (його спиртовий розчин використовується як дезінфікуючий засіб – зеленка). В сильно кислому середовищі його забарвлення жовте, а в сильно лужному розчин знебарвлюється [10].
Однак в лабораторній практиці використовується універсальний індикатор – суміш декількох індикаторів. Він дозволяє легко визначити не тільки характер середовища, але й значення кислотності (рН) розчину.
Індикатори застосовують найчастіше для встановлення кінця хімічної реакції. Розрізняють кислотно-основні, адсорбційні, окисно-відновні індикатори. Індикатори дають можливості визначати величину показника середовища (рН) [7].
Індикатори – речовини, які змінюють свою будову і фізичні властивості при зміні властивостей середовища. Частіше за все при цьому змінюється колір індикатора, іноді – люмінесценція.
Кислотно-основні індикатори являють собою розчинні органічні речовини, які змінюють своє забарвлення або люмінесценцію в залежності від концентрації іонів індикатора(рН середовища) [2; 8].
Окисно-відновні індикатори – це речовини, здатні адсорбуватися на поверхні осаду й змінювати при цьому забарвлення, інтенсивність люмінесценції [14].
1.2. Синтетичні кислотно-основні індикатори
Кислотно-основні індикатори змінюють будову та властивості при зміні pH середовища і їх називають кислотно-основними індикаторами [15].
Зміна кольору індикатора відбувається не відразу, стрибком, а у певному інтервалі змін pH, який називають інтервалом переходу індикатора, – з однієї форми в іншу. Кожен індикатор має свій інтервал переходу, який залежить від особливостей структури індикатора.
Наприклад, метиловий оранжевий змінює колір від червоного до жовтої в інтервалі pH 3,1-4,4 [19].
Відомо близько 200 кислотно-основних індикаторів, що відносяться до різних класів органічних сполук. Найбільш широке поширення одержали індикатори групи трифенілметану і азосполук [7].
Трифенілметанові індикатори. З цієї групи найчастіше застосовують фталеїнові і сульфофталеїнові індикатори. У фталеїнових індикаторів лактонне кільце під впливом лужного середовища розривається і утворюється хромофорна хіноїдна група. Із безбарвної лактонной форми виходить хіноїдна форма індикатора, яка має червоний або фіолетовий колір. До фталеїнових індикаторів відноситься фенолфталеїн 4,4-диоксифталофенон, який змінює колір від безбарвного в кислому середовищі до червоно-фіолетового в лужному. Під впливом pH молекула фенолфталеїну зазнає ряд перетворень [20].
Фенолфталеїн – порошок білого кольору, розчинний в етанолі. Інтервал переходу фенолфталеїна від безбарвної до червоно-фіолетової форми знаходиться в межах pH 8,2-10,0. У сильно-лужному середовищі (при pН > 12) відбувається знебарвлення розчинів фенолфталеїна внаслідок зникнення хіноїдної групи. Застосовують фенолфталеїн у вигляді 0,1 % розчину в 50 % еталоні. У медицині фенолфталеїн застосовують як проносний засіб (під назвою пурген) [7].
Тимолфталеїн – індикатор, аналогічний за структурою фенолфталеїну, містить два залишку тимолу: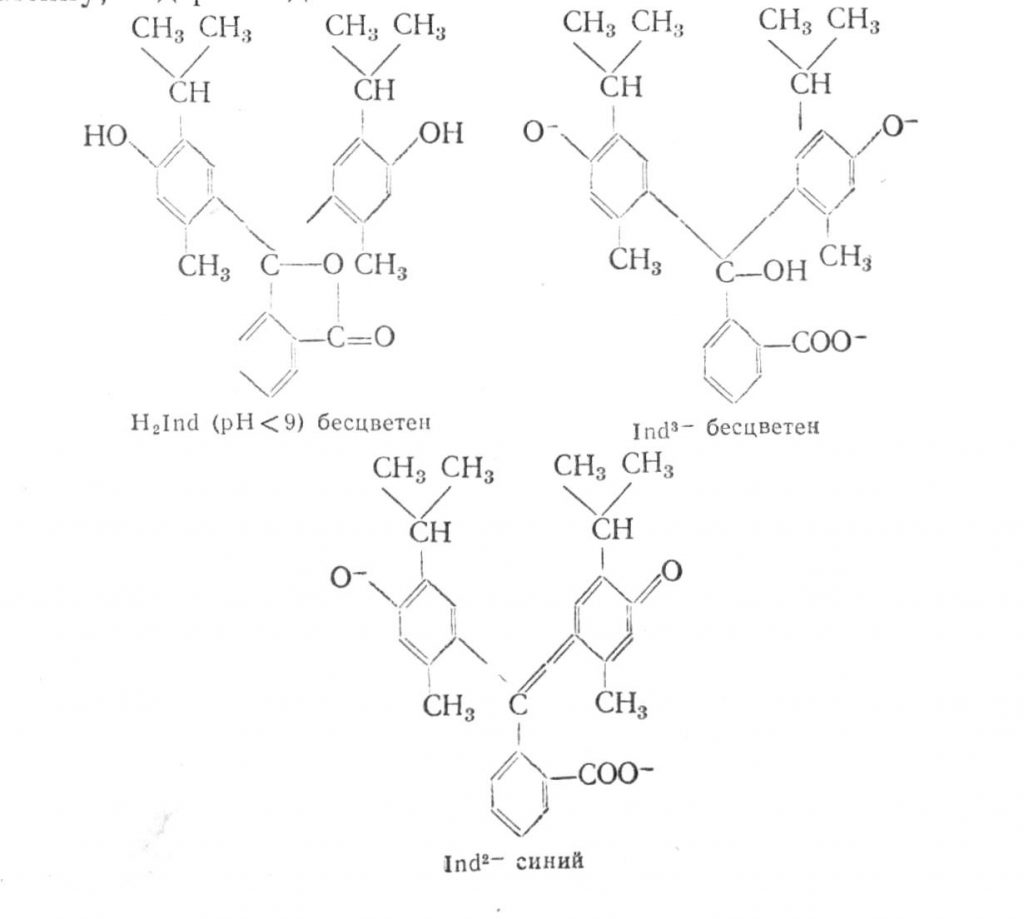
Порошок білого кольору. У кислому середовищі безбарвний, в лужному – стає синім внаслідок утворення хіноїдної групи. Інтервал переходу від безбарвною форми до синьої знаходиться в межах pH від 9,0 до 10,5. Застосовують 0,1%-ний розчин в 50%-ному етанолі.
Кристалічний фіолетовий – диметиламінне похідне трифенілметану являє собою кристали з бронзовим блиском. У розчинах може існувати в трьох формах: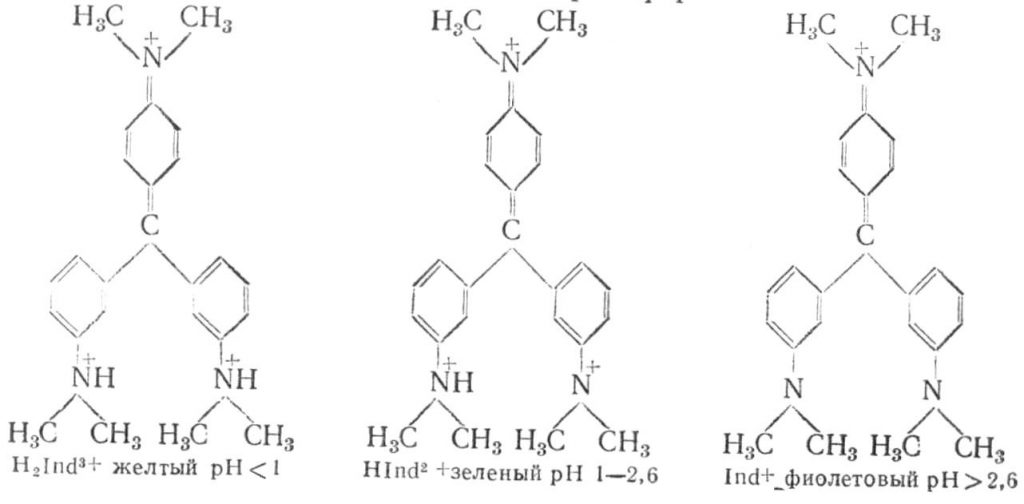
Індикатори групи азосполук. Азосполуки здатні залежно від рН середовища існувати в декількох формах, які мають різний колір. Метиловий оранжевий – натрієва сіль 4-диметиламіноазобензол 4′-сульфокислоти. Являє собою оранжево-жовтий порошок, який утворює розчин такого ж кольору в лужному середовищі. У кислому середовищі індикатор змінює забарвлення від жовтого до червоного внаслідок утворення хінондиімінної сполуки: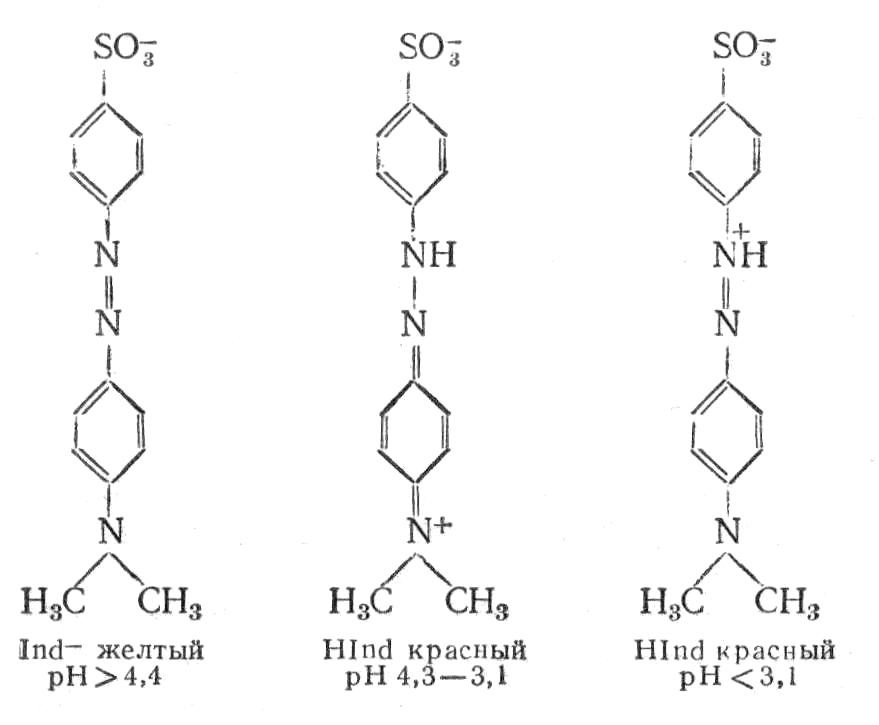
Інтервал переходу кольору від червоного до жовтого знаходиться в межах змін pH середовища від 3,1 до 4,4 [7].
Метиловий червоний – 4-N-диметиламіноазобензол-2′-карбонова кислота: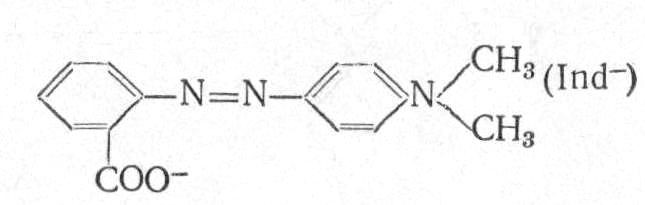
Це порошок червоно-бурого кольору. У лужному середовищі знаходиться у вигляді жовтої азоформи, в кислому – переходить в червону хіноїдну форму. Перехід від червоного кольору до жовтого відбувається в інтервалі pH від 4,2 до 6,2. Застосовують у вигляді 0,2%-ного розчину в 60%-ому етанолі.
Кислотно-основні індикатори використовують для визначення pH розчинів і при проведенні якісного та кількісного аналізу методом кислотно-основного титрування.
1.3. Природні кислотно-основні індикатори
Кислотно-основні індикатори дуже різноманітні; багато з них легко доступні і тому вони відомі не одне століття. Це відвари або екстракти забарвлених кольорів, ягід і плодів. Так, відвар іриса, тюльпанів, чорниці, ожини, малини, чорної смородини, червоної капусти, буряка і інших рослин стає червоним в кислому середовищі і зелено-блакитним – в лужному. Це легко відмітити, якщо помити каструлю із залишками борщу мильною (тобто лужною) водою. За допомогою кислого розчину (оцет) і лужного (питна, а краще – кальцинована сода) можна також зробити написи на пелюстках різних кольорів червоного або синього кольору [9].
Звичайний чай – теж індикатор. Якщо в стакан з міцним чаєм крапнути лимонний сік або розчинити декілька кристалів лимонної кислоти, то чай відразу стане світліший. Якщо ж розчинити в чаї питну соду, розчин потемніє (пити такий чай, звичайно, не слід). Чай же з квіток («каркаде») дає набагато яскравіші кольори [18]. Ймовірно, найстаріший кислотно-основний індикатор – лакмус (рис. 1.1).

Рис.1.1. Зовнішній вигляд лакмусу
Ще в 1640 ботаніки описали геліотроп (Heliotropium Turnesole) – запашну рослину з темно-ліловими квітками, з якої було виділено фарбувальну речовину. Цей фарбник, поряд з соком фіалок, став широко застосовуватися хіміками як індикатор, який в кислому середовищі був червоним, а в лужному – синім. Про це можна прочитати в працях знаменитого фізика і хіміка XVII століття Роберта Бойля. Спочатку за допомогою нового індикатора досліджували мінеральні води, а приблизно з 1670 року його почали використовувати в хімічних дослідах. «Як тільки вношу трохи малу кількість кислоти, – писав в 1694 французький хімік П᾿єр Поме про «турнесоле», – він стає червоним, тому якщо хто хоче взнати, чи міститься в чому-небудь кислота, його можна використовувати». У 1704 німецький учений М.Валентін назвав цю фарбу лакмусом; це слово і залишилося у всіх європейських мовах, окрім французького; по-французьки лакмус – tournesol, що дослівно означає той, що «повертається за сонцем». Так само французи називають і соняшник; до речі, «геліотроп» означає те ж саме, лише по-грецьки. Незабаром виявилось, що лакмус можна добувати і з дешевшої сировини, наприклад, з деяких видів лишайників [5].
На жаль, майже у всіх природних індикаторів є серйозний недолік: їх відвари досить швидко псуються – скисають або пліснявіють (стійкіші спиртні розчини). Інший недолік – дуже широкий інтервал зміни кольору. При цьому важко або неможливо відрізнити, наприклад, нейтральне середовище від слабокислої або слаболужного від сильнолужного. Тому в хімічних лабораторіях використовують синтетичні індикатори, що різко змінюють свій колір в досить вузьких кордонах рН. Таких індикаторів відома безліч, і кожен з них має свою сферу застосування. Наприклад, метиловий фіолетовий змінює забарвлення від жовтої до зеленої в інтервалі рН 0,13 – 0,5; метиловий помаранчевий – від червоної (рН < 3,1) до оранжево-жовтої (рН 4); бромтімоловий синій – від жовтої (рН < 6,0) до синьо-фіолетової (рН 7,0); фенолфталеїн – від безбарвної (рН < 8,2) до малинової (рН 10); тринітробензол – від безбарвної (pН < 12,2) до помаранчевої (рН 14,0) [6].
У лабораторіях незрідка використовуються універсальні індикатори – суміш декількох індивідуальних індикаторів, підібраних так, що їх розчин по черзі змінює забарвлення, відтворюючи всі барви веселки при зміні кислотності розчину в широкому діапазоні рН (наприклад, від 1 до 11). Розчином універсального індикатора часто просочують смужки паперу, які дозволяють швидко (хоча і з не дуже високою точністю) визначити рН аналізованого розчину, порівнюючи забарвлення смужки, змоченої розчином, за еталонною колірною шкалою.
Антоціани – це водорозчинні пігменти вакуолей рослин, які можуть бути червоних, фіолетових або синіх кольорів та їх відтінків в залежності від кислотності [8].
Антоціани легко розчинні у воді і полярних розчинниках, мало розчиннів спирті і нерозчинні у неполярних розчинниках. Будову антоціанів встановлено в 1913 німецьким біохіміком Р. Вильштеттером, перший хімічний синтез здійснений у 1928 англійським хіміком Р. Робінсоном.
Антоціани і антоціанідіни звичайно виділяються з кислих екстрактів рослинних тканин при помірно невисоких значеннях pH, в цьому випадку агліконова антоціанінова частина антоціану або антоціанін існують у формі флавіліевої солі [8].
Вони дозволені в якості харчових добавок (E163). Багаті антоціанами такі рослини, як, наприклад, чорниця, журавлина, малина, ожина, чорна смородина, вишня, баклажани, чорний рис, виноград Конкорд і мускатний виноград, червона капуста, і деякі види перців, як пекучих, так і солодких. У медицині широко застосовуються антоціани чорниці (у складі екстракту чорниці). У пекучих перцях також помічено декілька видів, у яких антоціан присутня не тільки в плодах, але і в листах. Причому, в даному випадку, антоціан синтезується тим більше, чим яскравіше сонячне світло, що падає на рослину. До таких перцям можна віднести Black Pearl (Чорна Перлина), Pimenta da Neyde та інші. Але в Чорній Перлині дозрілий плід повністю позбавляється антоціану, і плід-ягода червоніє, а у Pimenta da Neyde плід-стручок на сонці завжди залишається темним [9].
Розділ 2. Реактиви та методики експерименту
2.1. Правила техніки безпеки
Основні правила, яких потрібно дотримуватися при роботі в хімічній лабораторії:
- Не починати здійснювати дослід, доки не стане відомою його мета, доки не перевірено наявність обладнання, необхідного для досліду (посуд, прилади, реактиви).
- При роботі точно виконувати порядок і послідовність операцій, вказаних в інструкції.
- Дотримуватись всіх заходів безпеки, наведених в інструкції з техніки безпеки.
- Користуватися реактивами, приготованими для даного досліду.
- Перед використанням реактиву уважно вивчити етикетку на банці з метою встановлення придатності реактиву для даного досліду.
На етикетці, крім назви (або формули), має бути вказано про його чистоту: «технічний» (техн.), «чистий» (ч.), «чистий для аналізу» (чда), «хімічно чистий» (х. ч.). Етикетки на склянках з розчинами повинні містити інформацію про концентрацію розчину.
Якщо на склянці (банці) з реактивом немає етикетки або надпису, користуватися ним без погодження з викладачем неможна.
- Надлишок реактиву не висипати і не виливати назад з склянку, з якої він був взятий, а поміщати його в склянки-збирачі.
- Після використання реактиву банку або склянку відразу ж закрити пробкою і поставити на місце.
- Сухі реактиви брати фарфоровими, металічними, скляними ложечками, які повинні бути завжди сухими і чистими. Після використання їх слід ретельно витерти фільтрувальним папером.
- Якщо реактив відбирають піпеткою, то неможна тією ж піпеткою, не вимивши її, брати реактив іншої склянки.
- Всі досліди проводити в робочому халаті.
- Під час досліду дотримуватись тиші і порядку.
- Уважно слідкувати за ходом досліду і спостерігати всі зміни.
- Запис спостережень і рівнянь проводити реакцій робити відразу ж після закінчення досліду в лабораторному журналі.
- Після закінчення досліду необхідно вимити хімічний посуд, привести до ладу робоче місце.
Обов’язкові вимоги до техніки безпеки при роботі в хімічній лабораторії
При роботі в хімічній лабораторії потрібно пам’ятати, щоб при виконанні кожного хімічного досліду вимагається обачність і увага!
- При користуванні реактивами необхідно знати їх основні властивості: вогненебезпечність, отруйність, здатність до утворення вибухових сумішей з іншими реактивами.
- Всі роботи з сильнопахнучими і отруйними речовинами, з концентрованими розчинами кислот і лугів, з лужними металами проводити у витяжній шафі.
- При роботі у витяжній шафі дверці витяжної шафи треба підняти на 1/5 – 1/4 висоти її підйому. Після завершення роботи її необхідно щільно закрити.
- Забороняється досліджувати властивості речовин без дозволу викладача, а також пити воду з хімічного посуду.
- Не нюхати, гази, що виділяються, близько до склянки. При визначенні запаху газу або рідини слід вдихати повітря, направляючи рукою його потік від посуду до себе.
- Забороняється виконання дослідів у брудному посуді.
- При наливанні реактивів не нахилятися над посудом, щоб запобігти попаданню частинок на обличчя або одяг.
- Не нахилятися над посудом з рідиною, що нагрівається, так як її може викинути з посуду.
- При нагріванні пробірки не тримати її отвором до себе чи в сторону товаришів.
- При розбавленні концентрованих розчинів сульфатної кислоти необхідно приливати її тонким струменем в воду, а не навпаки.
- Відпрацьовані розчини кислот і лугів неможна зливати в каналізацію.
- Відходи лужних металів масою до 2 г знищуються шляхом розчинення їх в етиловому спирті.
- У випадку загорання одягу слід гасити полум’я обгортанням в ковдру або пальто та ін. В жодному випадку не тікати
- Якщо загоряться електричні проводи, потрібно негайно виключити лічильник і гасити пожежу засобами, що є (пісок, вода, азбестова ковдра) [50].
2.2. Реактиви
Для приготування індикаторів з рослинної сировини рекомендується, використовувати забарвлені рослини або їх частини. Вибір рослинного матеріалу для приготування індикаторів необмежений. Існують різні способи приготування індикаторів.
2.2.1. Приготування та аналіз розчинів природних барвників
Обладнання: мірний циліндр 50 або 100 мл – 1 шт.; стакан хімічний 100 мл – 1 шт.; лійка – 1 шт.; колба конічна з пробкою 50 мл – 3 шт.; фарфорова ступка (за необхідності) – 1 шт.; одноразові ложечки для відбору сировини; пробірки; штатив для пробірок; промивалка; фільтрувальний папір; аркуш білого паперу; електрична плитка
Реактиви: сировина для виділення барвників (ягоди, коріння, листя тощо у свіжому вигляді, або продукти їх переробки); тестові розчини з різним показником рН; дистильована вода.
2.2.2. Приготування розчинів природних барвників
- Наважку сировини масою приблизно 10-15 г за необхідності подрібнити (нарізати або розтерти в ступці) і помістити у хімічний стакан. Долити близько 50 мл дистильованої води, перемішати, довести до кипіння і кип’ятити до отримання насиченого кольору (для свіжих або морожених соковитих ягід або коріння – достатньо 5–10 хв, для сухої сировини час кип’ятіння слід збільшити до 20 – 30 хв.).
- Отримані розчини охолодити до кімнатної температури, профільтрувати через скляну лійку з паперовим фільтром у підготовлені підписані колби, закрити корками.
ВАЖЛИВО! Соки деяких ягід та фруктів здатні до утворення гелів при охолодженні. Відвари такої сировини обережно фільтрують гарячими.
- Отримані екстракти використовують у подальшій роботі для визначення їх індикаторних властивостей.
- Охарактеризувати отримані розчини барвників, визначити їх колір, значення рН розчину (за методикою, наведеною раніше). Результати занести в таблицю, вказавши назву та частину рослини, з якої отримували барвник, а також вигляд сировини.
Розділ 3. Експериментальне дослідження природних кислотно-основних індикаторів
3.1. Виготовлення індикаторів зі свіжої сировини
Ми приготували по 50г свіжих плодів, які необхідно подрібнити в ступці, залити 200мл води і кип’ятити протягом 2-3 хвилин. Потім охолоджений і відфільтрований розчин розбавити спиртом у співвідношенні 2:1 з метою збереження розчину від псування.
За даною методикою ми виконали розчини зі свіжої чорної смородини, з моркви , з малини, з винограду, з. Також були досліджені синя цибуля, гранат, ківі, синя та зелена капусти, буряк, калина (табл. 3.1).
Експериментальне підтвердження індикаторних властивостей залежить від рН середовища, тому до двох зразків кожного новоутвореного розчину ми додавали в одну пробірку – лугу, а в іншу – кислоту. Якщо в пробірках відбувається характерна зміна кольору, то обрана нами речовина проявляє індикаторні властивості.
Як показали дослідження, найкраще в ролі індикаторів кислотно – основного середовища виступають: синя капуста та цибуля, чорна смородина, оскільки відбувається інтенсивна зміна кольору.
Для дослідження лише лужного середовища найкраще підходять малина, гранат та калина. А от для визначення кислого середовища, вони не підходять. Тому що, вони мають червоний розчин у нейтральному середовищі і погано видно перехід кольору в кисле середовище.
Сік винограду набуває червоного кольору в кислому середовищі.
Зовсім не підходять для виявлення рН – розчину: томат, морква, лимон, ківі, зелена капуста, буряк.
3.2. Виготовлення індикаторів з сушеної сировини
Для виготовлення індикаторів з сушеної сировини, необхідну сировину подрібнюють і заливають окропом. Дають настоятись до утворення інтенсивного забарвлення. Готовий настій треба відфільтрувати і можна використовувати в якості індикаторів.
Мі приготували розчини з сушеного яблука, сушеної чорної смородини, луски синьої цибулі, і як показали досліди найкраще виступають в ролі індикаторів синя цибуля та чорна сушена смородина, сушене яблуко не дало бажаних результатів.
В ході даного експерименту ми дослідили індикаторні властивості чаю. Для цього ми приготували різні сорти чаю: чорний та зелений. Два зразки темнішали в лужному середовищі та світлішали в кислому.
Дослід з кавовими зернами не дав бажаного результату. І в кислому, і в лужному середовищі не виявлено змін. Результати занесені до таблиці 3.1.
3.3. Виготовлення індикаторів з пелюсток квітів
50г пелюсток квітів подрібнити в ступці, залити 200мл води і кип’ятити протягом 2 – 3 мінути. Потім охолоджений і відфільтрований розчин розбавити спиртом у співвідношенні 2:1 з метою оберігання розчину від псування.
Ми обрали квіти з яскравим забарвленням, такі як чорнобривці та троянди.
Таблиця 3.1.
Експериментальне дослідження індикаторних властивостей при різному значенні рН середовищі
|
№ |
Природній індикатор |
Середовище |
||
|
лужне |
нейтральне |
кисле |
||
|
1 |
Чорна свіжа смородина |
зелене |
бузкове |
рожеве |
|
2 |
Морква (сік) |
прозоре |
морквяне |
прозоре |
|
3 |
Томатний сік |
рожеве |
червоне |
рожеве |
|
4 |
Малина |
темно-зелене |
малинове |
морквяне |
|
5 |
Виноград (зелений) |
прозоре |
зелене |
рожеве |
|
6 |
Лимон |
прозоре |
прозоре |
прозоре |
|
7 |
Цибуля (синя) |
світло зелене |
фіолетове |
червоне |
|
8 |
Гранат (сік) |
темно синє |
темно червоне |
помаранчеве |
|
9 |
Ківі |
світло зелене |
зелене |
світло зелене |
|
10 |
Червонокачанна капуста (відвар) |
зелене |
синє |
рожеве |
|
11 |
Зелена капуста |
прозоре |
зелене |
прозоре |
|
12 |
Чай чорний |
темно коричневе |
коричневе |
світло коричневе |
|
13 |
Чай зелений |
темно коричневе |
коричневе |
світло коричневе |
|
14 |
Кава |
коричневе |
коричневе |
коричневе |
|
15 |
Буряк (сік) |
жовто-коричневе |
червоне |
рожеве |
|
16 |
Калина |
синьо-зелене |
червоне |
помаранчеве |
|
17 |
Плоди шипшини |
червоне |
рожеве |
зелене |
|
18 |
Виноград (синій) |
червоне |
фіолетове |
зелене |
|
20 |
Пелюстки чорнобривців |
рожеве |
оранжеве |
жовте |
|
21 |
Пелюстки троянд |
рожеве |
червоне |
коричневе |
Висновки
Індикатори – це органічні барвники складної будови зі слабкими кислотними або основними властивостями, які змінюють своє забарвлення залежно від pH середовища. Вони бувають одноколірними (наприклад, фенолфталеїн) або двоколірними (наприклад, метиловий оранжевий, метиловий червоний та iн.).
В ході наукової роботи була досліджена дія природних кислотно-основних індикаторів на кислотно-основне середовище.
- Найкраще проявляють себе як індикатори рослини з малиновим, синім, фіолетовим кольорами, такі як: чорна смородина, червоно-качанна капуста.
- Найкраще для лужного середовища підходять плоди червоного та малинового кольору: калина, малина та гранат.
- Для кислого середовища підходять виноград. Досліджено експериментально, чай також може сигналізувати про рН – розчину, у кислому середовищі розчин чаю світлішає, а в лужному – темнішає.
- Дуже погано, або зовсім не підходять для дослідження середовища рослини, такі як: зелена капуста, томат, морква, лимон, ківі тощо.
Список використаних джерел
- Аналитическая химия. Проблемы и подходы: в 2 ч. [Текст] / Р. Кельнер, Ж.-М. Мемре, М. Отто, Г.М. Видмер. – М.: Мир, 2004. – Ч. 1 – 608 с.
- Аналітична хімія: підручник / [Д. Д. Луцевич, А. С. Мороз, О. В. Грибальська та ін.] ; 2-е вид., перероб. і доп. – К.: Медицина, 2009. – 416 с.
- Ахметов Н. С. Неорганическая химия. Учебн. Пособие для вузов. Изд. 2-е, перераб. и доп. М., «Высшая школа», 1975. 672с.
- Бишоп Э. Индикаторы / Э. Бишоп – М.: Мир, 1976. – 496 с.
- Більченко М. М. Лабораторний практикум з аналітичної хімії. Кількісний аналіз: Навчальний посібник. – Суми: ВТД «Університетська книга», 2007 – 142 с.
- Глинка Н. Л.; под ред. В. А. Рабиновича. Общая химия/ Н. Л. Глинка. – Киев: Вища школа. Главное изд-во, 1982. – 609 с. – Укр.
- Жиряков В. Г. Органическая химия / В. Г. Жиряков– М.: Химия, 1971. – 496 с.
- Коган И. М. Химия красителей. / И. М. Коган – М.: Государственное научно-техническое издательство химической литературы, 1956. – 699 с.
- Коренман И. М. Органические реагенты в неорганическом анализе / И. М. Коренман – М.: Химия, 1986. – 321 с.
- Крешков А. П. Основы аналитической химии. Теоретические основы. Качественный анализ, книга первая, изд. 4-е, перераб. М., «Химия», 1976, 472с.
- Лашевська Г. А. Хімія 7 клас – К.: Генеза, 2007, – 345 с.
- Логинов Н. Я. И др. Аналитическая химия: Учеб. пособие для студентов хим.-биол. И биол.-хим. спец. пед. ин-тов/ Н. Я. Логинов, А. Г. Воскресенский, И. С. Солодкин. – 2-е изд., перераб. – М.: Просвещение, 1979. – 480с., ил.
- Лурье Ю. Ю. Справочник по аналитической химии / Ю. Ю. Лурье. – М. : Химия, 1971. – 448 с.
- Несмеянов А.Н., Несмеянов Н. А. Начала органической химии. / А. Н. Несмеянов, И. А. Несмеянов – М.:Химия, 1974. – Т.2. – 744 с.
- Органические реагенты в неорганическом анализе / [Хольцбехер З., Дивиш Л., Крал М., Влачил Ф.] – М.: Мир, 1979. – 490 с.
- Пилипенко А. Т., Пятницкий И. В. Аналитическая химия: В двух книгах: кН. 1 – М.: Химия, 1990. 480с. ил.
- Пономарев В. Д. Аналитическая химия в (двух частях). [Учебник для фармац. и фак. мед. ин-тов.] / В. Д. Пономарев – М.: Высш. школа,1982. – Ч. 2. Количественный анализ – 288 с., ил.
- Стародуб В. А. Общая химия: Учебное пособие / Худож.-оформитель Л. Д. Киркач-Осипова. – Харьков: Фолио, 2007. – 378с.
- Степанов Б. И. Введение в химию и технологию органических красителей / Б. И. Степанов – М.: Химия, 1971. – 448 с.
- Телегус В. С., Бодак О. І., Заречнюк О. С., Кінжибало В. В. Основи загальної хімії / за ред. В. С. Телегуса: Підручник – Львів: Світ, 2000. – 424 с.
- Український медичний альманах, 2014, Том 17, №1
- Цитович И. К. Курс аналитической химии. Ученик для сель-хоз. вузов – 5-е изд., испр. и доп. – М.: Высшая шк., 1985. – 400с., ил.
Редакція може не поділяти думку авторів і не несе відповідальність за достовірність інформації. Будь-який передрук матеріалів з сайту може здійснюватись лише при наявності активного гіперпосилання на e-kolosok.org, а також на сам матеріал!






