Хімічні елементи не просто скніють у клітинках таблиці Менделєєва. Вони живуть і вирують навколо нас у простих речовинах, домішках, сумішах або розчинах, вони входять до складу сполук, які взаємодіють між собою, і цей вир називається кругообігом хімічних елементів у природі. Ми не можемо без них обійтися у побуті, науці, виробництві. Ми самі (і все навкруги) складаємося з них. Ось чому хімія така важлива у нашому житті. Щоб переконатися у цьому, скористаємося нетрадиційними таблицями Менделєєва, які наочно демонструють застосування хімічних елементів.
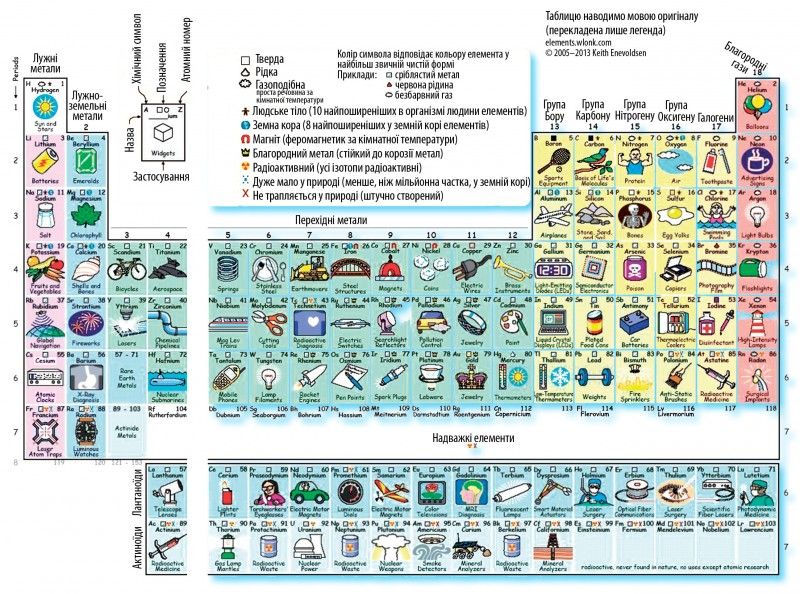
У першій таблиці наведені найбільш відомі напрямки використання властивостей хімічних елементів та/або їхнє знаходження у природі. А ще у комірках є позначки, які повідомляють нам додаткову інформацію про елемент:
- який агрегатний стан та колір має відповідна проста речовина за нормальних умов;
- чи належить він до 10 найпоширеніших в організмі людини чи 8 найпоширеніших у земній корі;
- чи є він феромагнетиком за кімнатної температури;
- чи стійкий він до корозії, якщо це метал;
- чи радіоактивний;
- чи, бува, не створений він штучно;
- чи, може, його дуже мало у природі.
Уважно розглянувши цю таблицю, ми можемо переконатися, що Гідрогену багато на Сонці та зорях, а в земній атмосфері є Оксиген; Берилій містять смарагди, у різних овочах та фруктах є Калій, а Кальцій і Фосфор – у кістках, Силіцій містять пісок та каміння і, звісно, що основою всіх живих організмів є Карбон.
Уважний дослідник таблиці побачить, що у складі різноманітних сполук нашого організму або у його вільних йонних формах найбільше Гідрогену, Карбону, Нітрогену, Оксигену, Натрію, Фосфору, Сульфуру, Хлору, Калію та Кальцію. Гідроген і Оксиген – макроелементи, які утворюють прості речовини водень і кисень та воду, якої в організмі дорослої людини в середньому приблизно 65 %. Вода нерівномірно розподілена по органах, тканинах і біологічних рідинах людини. У шлунковому соку, слині, плазмі крові, лімфі частка води становить 90–99,5 %; у сірій речовині головного мозку, печінці, шкірі, спинному мозку, м’язах, легенях, серці – 70–80 %. Найменше води (40 %) містить скелет.
Дуже цікавий біологічний вплив кисню на організм. Попри те, що він нам постійно необхідний для дихання, за високої концентрації та тиску кисень діє як отрута. Кисневе отруєння можливе за використання кисневих і регенеративних апаратів, штучних газових сумішей для дихання, під час проведення кисневої рекомпресії, а також внаслідок перевищення лікувальних доз у процесі оксигенобаротерапії.
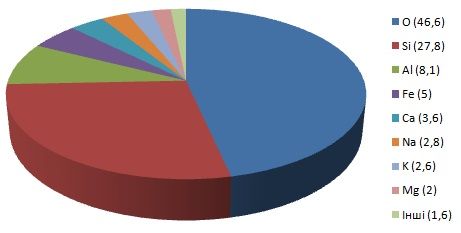
У земній корі найбільшу частку за масою становлять Оксиген, Натрій, Магній, Алюміній, Силіцій, Калій, Кальцій і Ферум. Як бачимо, тут переважають метали, на відміну від організму людини, де першість належить неметалам. Цікаво, що хімічний склад земної кори відрізняється від хімічного складу Землі загалом. Найбільш поширеним елементом Землі є Ферум, на відміну від земної кори, де найбільше Оксигену. Крім того, хімічний склад земної кори постійно оновлюється за рахунок міграції елементів між різними шарами кори, а також через те, що між материками й океанами відбувається взаємний обмін речовинами.
Стійких до корозії – так званих благородних – металів вкрай мало, а їхній вміст у земній корі мізерний. Саме така рідкість та широкий спектр застосування зумовили високу ціну на благородні метали. Найдорожчими з них є (від дешевшого до дорожчого) рутеній, осмій, золото, платина, родій. Особливе місце серед благородних металів споконвіку відводять золоту (хімічний елемент Аурум). Ти його легко віднайдеш у поданій таблиці: комірку Ауруму прикрашають відразу дві корони (одна – за непідвладність іржі, друга – за те, що має широке застосування у ювелірній справі, та й взагалі словосполучення „золота корона” вже перетворилося на сталий вираз).
Які ще метали зараховують до благородних? Це так звані платинові метали (рутеній, родій, осмій, іридій, паладій, платину), реній і, звісно, срібло. Платина зазвичай асоціюється з ювелірною справою, та в таблиці ми бачимо, що її застосовують у скляній промисловості для виробництва лабораторного посуду. До речі, важливим компонентом для виготовлення такого посуду є родій. Зі сплаву родію та платини виготовляють лабораторний посуд з високою хімічною та термічною стійкістю. Водночас компоненти з платини виконують ключову роль у виробництві скла для панелей активних матриць тонкоплівкових транзисторних рідкокристалічних дисплеїв, які використовують у більшості телевізійних і комп’ютерних екранів, а родій у чистому вигляді використовують для виготовлення дзеркал і рефлекторів освітлювального устаткування. У 70-ті роки ХХ століття платину застосовували також у автомобільних каталізаторах, які забезпечували спалювання вихлопів автомобілів, відтак, покращуючи екологічну ситуацію. Та згодом платина поступилася місцем паладію. Сьогодні понад 60 % усього паладію використовують у виробництві автомобільних каталізаторів.
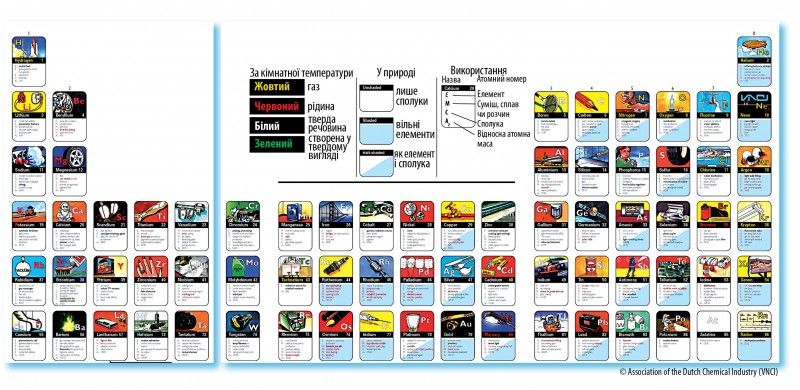
Автори другої таблиці більше зосередились на застосуванні хімічних елементів. Вони навели не лише сферу застосування простої речовини, яка відповідає елементу, а й сполук цієї речовини або сумішей, сплавів чи розчинів, які містять її. Крім того, вони графічно позначили, у якому вигляді елемент є у природі (у складі сполуки, у чистому вигляді чи в обох іпостасях) та який агрегатний стан має за кімнатної температури.
Таким чином, друга таблиця доповнює відомості про елементи, подані у першій. Так, ми вже не тільки знаємо, що Гідроген є на Сонці, але й те, що на Землі цей газ використовують у чистому вигляді як ракетне паливо та для виготовлення насичених жирів1. Широке застосування має сполука водню – аміак: для виробництва нітратних добрив, вибухівки, полімерів, соди та інших продуктів хімічної промисловості.
1 Про насичені і ненасичені жири читай у статті Олени Князевої „Обережно, не з’їж обгортку!” у журналі „КОЛОСОК” № 1/2013.
А як щодо наступного елементу – Гелію? У першій таблиці бачимо лише зображення повітряних кульок. З другої таблиці довідуємося, що гелій у чистому вигляді – це ще й наповнювач дирижаблів і аеростатів, шукач теч, охолоджувач у ядерному реакторі.
А суміші гелію і деяких інших газів (кисню, азоту) застосовують для дихання під час дайвінгу. Цікаво, що за вдихання гелію змінюється тембр голосу, його звучання набуває штучного відтінку. Це відбувається через те, що у гелії швидкість звуку вища, ніж у повітрі, і наш природний резонатор створює звук з тією ж довжиною хвилі, але з більшою частотою. За переходу із заповненої гелієм глотки у повітря назовні частота звуку вже не зменшується, тому ми чуємо цей вібруючий високий, зовсім не схожий на звичний людський голос. Одного вдиху зі звичайної повітряної кульки, заповненої гелієм, вистачить, щоб вразити друзів своїм цікавим голосом. Однак дихати чистим гелієм тривалий час не можна: за відсутності кисню людина може втратити свідомість і навіть померти, якщо їй вчасно не надати допомоги.
Можна довго і докладно розповідати про застосування різних форм існування кожного хімічного елементу, тим паче, що їхній спектр застосування дуже широкий. Але таблиці вже зробили це за нас просто і наочно. Тож придивімося пильніше до них і з’ясуймо, які елементи в обох таблицях представлені однаково.
У комірці Бору бачимо тенісні ракетки. Цікавий вибір зображення, мабуть, пов’язаний з тим, що їх найлегше зобразити. Загалом для виготовлення тенісних ракеток використовують також графіт, алюміній, титан, кевлар. Ракетки, виготовлені зі сполук бору, не радять використовувати новачкам, адже попри свою легкість та міцність вони передають ударні вібрації на руку і плече. Натомість рекомендують придбати ракетки зі сполук графіту.
Історія світової авіації тісно пов’язана з алюмінієм і його сплавами. То й не диво, що два літачка „здійснили посадку” у комірках № 13 обох таблиць. Вперше „авіаційний” алюміній з’явився у Німеччині на початку ХХ століття. У той час був запатентований і впроваджений на виробництві відкритий Альфредом Вільмом надміцний сплав – дюралюміній, названий так за місцем його відкриття (м. Дюрен). До складу цього сплаву входять алюміній, мідь, магній і марганець. Дюралюміній фактично став базовим для розвитку авіаційних сплавів. Сьогодні алюміній широко використовують у авіаційній промисловості. Частка алюмінію становить від 2/3 до 3/4 маси нетто пасажирського літака. Незаперечними є достоїнства алюмінієвих сплавів для створення об’єктів космічної техніки. Ще 1865 року Жуль Верн у своєму фантастичному романі „Подорож на Місяць” докладно описав ракету з алюмінію. І, як і більшість його прогнозів, це передбачення справдилося. Завдяки високим питомій міцності та жорсткості алюмінієвих сплавів з них виготовляють баки, міжбакові і носові частини ракети (загалом від 1/20 до 1/2 маси нетто ракети становить алюміній). Серед переваг алюмінієвих сплавів – працездатність за кріогенних температур у контакті з рідким киснем, воднем і гелієм. Вони зазнають так званого кріогенного зміцнення, тобто зі зменшенням температури їхні міцність і пластичність зростають.
Якщо ти хоч раз відвідував плавальний басейн, то, мабуть, відчував специфічний запах хлору, який використовують для дезінфекції води. Ось чому у комірці №17 обох таблиць хлюпає вода і плавають люди. Хлорування води застосовують і для знезараження питної води, проте дедалі частіше цей процес намагаються замінити озонуванням.
Більшість з нас знає, що нитка розжарення лампи виготовлена з вольфраму. Цей факт ілюструють обидві таблиці. Однак у комірках Аргону і в першій, і в другій таблиці знову ж таки бачимо лампу розжарення. Чому? Все просто: аргоном заповнюють скляні колби для зменшення швидкості випаровування вольфраму через нагрівання. Цікаво, що у перших лампах розжарення не було ані вольфраму, ані аргону. Нитки розжарення виготовляли з вугілля, а колби були вакуумні.
У комірці Феруму бачимо мости в обох таблицях. Друга таблиця підказує нам, що як матеріал для побудови моста використовують сплави заліза: сталь і чавун. Найвідоміший у світі міст із чавуна так і називається Iron Bridge („залізний міст”). Це міст через річку Северн у Великій Британії. Він відкритий 1781 року і є першим у світі металевим арочним мостом. Серед українських топонімів також натрапляємо на залізо: на карті України в Херсонській області є село Залізний Порт. Подейкують, що свою назву це село отримало через те, що раніше тут був залізний пірс, а з кораблів вивантажували зерно в комору із залізним дахом, який моряки помічали ще здалеку. Існує й інша версія: начебто назва завдячує аж ніяк не залізу, а українському дієслову „залізти” („І залізло це село під саме море”, – казали корінні мешканці).
Може, дехто й здивувався, побачивши, що обидві таблиці розмістили у комірці Ніколу монети. Звісно, нікель не завжди використовували для чеканки монет. У давнину монети найчастіше чеканили із золота, срібла та міді, а також їхніх сплавів, часом використовували свинець, залізо та олово. Зараз крім цих металів використовують також алюміній, цинк, нікель, паладій, платину. Щодо нікелю, то назву цього металу навіть отримав певний вид монет – 5 центів США.
Цікаво, що в комірках Галію (у таблиці 1) та Арсену (у таблиці 2) бачимо схожі зображення електронних годинників з однаковим підписом „Світлодіоди”. Це легко пояснити. Для виробництва світлодіодів часто використовують хімічну сполуку галію та миш’яку (галій арсенід), який є важливим напівпровідником.
Селен має фотоелектричні властивості. Якщо поверхню, вкриту селеном, зарядити статичною електрикою, а потім опромінити світлом, то на засвічених ділянках поверхні заряд зникне. Саме цей ефект використовують у роботі лазерних принтерів та копіювальних апаратів, зображених у комірці Селену в обох таблицях.
У обох таблицях також є комірки із зображенням посуду. Щоправда, в першій таблиці це комірка Хрому, а у другій – Аргентуму. Хром прихистив у своїй комірці посуд через те, що його додають до заліза під час виробництва нержавіючої сталі, з якої виготовляють посуд, стійкий до окиснення навіть за високих температур, а отже, довговічний. Срібло для виготовлення посуду почали використовувати ще у ХІІІ столітті. Сьогодні столове срібло – це елітний посуд, найчастіше його купують не для щоденного вжитку, а для особливих випадків, для створення сімейної реліквії тощо.
А ось олово застосовують у виробництві консервних бляшанок: ним покривають бляшанки зсередини для запобігання окисненню заліза та псуванню продуктів, що зберігаються там. Часом юні хіміки-аматори навіть ставлять досліди для отримання олова з консервних бляшанок. Саме тому у комірці Стануму в обох таблицях красується консервна бляшанка.
А ось чому у комірці Йоду бачимо в обох таблицях напис „Дезінфекція”, мабуть, здогадалися усі. Кому з нас мама в дитинстві не намащувала забите коліно йодом, а точніше, спиртовим розчином йоду?
У комірці Гафнію бачимо атомний підводний човен. Швидше за все, це натяк на „Наутілус” – перший підводний човен, де були випробувані стрижні з гафнію. Саме з цього моменту, у 50-х роках ХХ століття зросло виробництво гафнію через його велике значення для атомної техніки. Це пояснюється його здатністю поглинати теплові нейтрони, а також стійкістю до корозії у гарячій воді.
Аналізуючи першу таблицю, ми досить докладно розповіли про застосування благородних металів. Та несправедливо оминули осмій. Цей метал досить довго „шукав своє покликання”. Оскільки це тугоплавкий метал, з нього спершу (після вугілля, але до вольфраму) виготовляли нитки розжарення у лампах.
Та оскільки осмій крихкий, він не затримався надовго на цій „посаді”. Пізніше саме крихкість забезпечила осмію нову „роботу”: розкришений до порошку, він слугував каталізатором під час синтезу аміаку. Згодом його замінили порошковим залізом. Та знайшлася „професія”, у якій осмій обійшов і навіть усунув такого серйозного конкурента, як золото. Золоті авторучки – це дуже престижно. Але є одна маленька деталь у цій ручці, яку аж ніяк не можна виготовляти із золота, адже воно занадто м’яке, – це кінчик пера. Під час писання ручкою перо витримує надзвичайне навантаження: на нього тиснуть згори, труть об папір – і то досить довго! Тож пера авторучок почали виготовляти зі сплаву твердих металів платинової групи: осмію та іридію. Тому в обох таблицях у комірці Осмію лежить саме авторучка, а в другій таблиці вона навіть обернена до нас іридієво-осмієвим пером.
Цікаво, а в якій комірці ти намалював би термометр? Перша відповідь, яка спадає на думку, мабуть, – це комірка Меркурію? Адже саме ртуттю (простою речовиною Меркурію) заповнюють трубки термометрів2. Та вже у першій таблиці бачимо, що термометр є не лише у цій комірці, але й у сусідній, яка належить Талію. А у другій таблиці ситуація ще дивніша: там лише Талій отримав зображення термометра. На цьому зображенні термометр знаходиться у руках тепло вдягнутої людини на тлі засніженого пейзажу. На що натякають нам автори цієї таблиці? На те, що сплав ртуті з талієм застосовують у низькотемпературних термометрах. Цей сплав має найнижчу температуру плавлення серед усіх відомих металів та сплавів (–60 °С).
2Чому саме ртуттю заповнюють трубки термометрів, читай у статті Олега Орлянського „Теплота і температура” у журналі „КОЛОСОК” № 4/2013.
Як бачимо з усіх цих прикладів, своє застосування хімічні елементи знаходять на основі фізичних і хімічних властивостей їхніх простих речовин, сполук, сумішей та сплавів. Багато в чому усіма благами цивілізації, якими щодня користуємося, ми завдячуємо хімії і хімікам, що відкрили для нас усі ці властивості. Тож радимо уважно роздивитися дві наведені таблиці. Можливо, зображення у деяких комірках тебе здивують та заінтригують і надихнуть дізнатися більше про навколишній світ і нас самих.