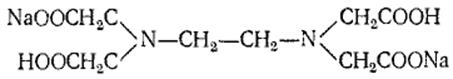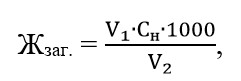Виконала:
Ясиненко Лілія,
учениця Маріупольського механіко-металургійного
коледжу Державного вищого навчального закладу
„Приазовський державний технічний університет”
Науковий керівник:
Бистрова Юлія Віталіївна,
учителька хімії
Маріупольського механіко-металургійного
коледжу Державного вищого навчального закладу
„Приазовський державний технічний університет”,
лауреатка IV Всеукраїнського Інтернет-конкурсу
„УЧИТЕЛЬ РОКУ–2019” за версією
науково-популярного природничого журналу
„КОЛОСОК” у номінації „Хімія”
Вступ
Здоров’я населення знаходиться в прямій залежності від складу природних вод в джерелах, з яких здійснюється регулярне водопостачання даної території. Щодня людина вживає 1,5-2,5 літра води, яка не повинна, в ідеалі, містити ніяких шкідливих домішок, що негативно впливають на здоров’я людини. У той же час, питна вода повинна містити достатню кількість мікроелементів, що беруть участь в обмінних процесах людини.
У природі вода ніколи не зустрічається у вигляді хімічно чистої сполуки. Маючи властивості універсального розчинника, вона постійно несе велику кількість різних елементів і сполук, склад і співвідношення яких визначається умовами формування води, складом водоносних порід. Великий вплив на склад природних вод, як поверхневих, так і підземних, надає техногенне забруднення.Метою науково – дослідної роботи є аналіз якості питної природної води.Для проведення аналізу було взято 3 зразка води:1. Джерело в Володарському районі (25 км від Маріуполя) (Проба 1)2. Джерело в Кальміуському районі (Проба 2)3. Старокримське водосховище (Проба 3)Для досягнення мети дослідження були поставлені такі завдання:- кількісне визначення загальної жорсткості (вміст іонів Mg 2+ і Ca 2+);- визначення рН досліджуваної води;- кількісне визначення мінералізації (сухого залишку) досліджуваної води.
1. Теоретична частина
1.1 Загальна жорсткість води
1.1.1 Загальна характеристика
Жорсткою називається вода, що містить велику кількість розчинених солей кальцію і магнію. Розрізняють загальну, тимчасову (карбонатну), постійну (некарбонатну) жорсткості. Одиниці виміру моль/м3 або ммоль/дм3.
Загальною жорсткістю називається сумарна концентрація іонів Ca2+, Mg2+ у воді.
Постійною (некарбонатною) жорсткістю називається частина загальної жорсткості, яка залишається після кип’ятіння води протягом певного часу. Некарбонатна жорсткість – частина загальної жорсткості, що дорівнює різниці між загальною і карбонатною жорсткістю.
Тимчасовою (карбонатною) жорсткістю називається частина загальної жорсткості, еквівалентна концентрації карбонатів і гідрокарбонатів кальцію і магнію. Карбонатна жорсткість – це частина загальної жорсткості, що видаляється кип’ятінням води протягом певного часу. Вона дорівнює різниці між загальною і постійною жорсткістю.
Використання жорстких вод для господарсько-побутових і промислових потреб призводить до дуже небажаних наслідків.1. Посилення корозії парових котлів і теплообмінників внаслідок гідролізу магнієвих солей і підвищення концентрації водневих іонів в розчині:
Mg2 + + 2H2O → Mg(OH)2 + 2H+
- Відкладення накипу на поверхні теплообмінних апаратів (котлів, холодильників), знижує економічність роботи цих установок. Накип має малу теплопровідність і збільшує непродуктивний витрата палива. Метал під накипом перегрівається і розм’якшується. Це призводить до утворення здуття і тріщин в трубах парових котлів.
- У жорсткій воді погано розварюються продукти, знижується їх поживна цінність. Білки переходять в нерозчинний стан, погано засвоюються організмом.
- Передчасний знос тканин при пранні в жорсткій воді. Волокна тканин сорбують кальцієві і магнієві мила, а це робить їх крихкими і ламкими.
1 моль/м3 жорсткості дорівнює 20,04 г/м3 іонів Са 2+; 12,153 г/м3 іонів Mg2+.
Розрізняють п’ять класів жорсткості води:
I Дуже м’яка – жорсткість 0-1,5 ммоль/дм3;
II М’яка – жорсткість 1,5- 3 ммоль/дм3;
III Середньої жорсткості – жорсткість 3-4,5 ммоль/дм3;
IV Досить жорстка – жорсткість 4,5-6 ммоль/дм3;
V Жорстка – жорсткість 6-10 ммоль/дм3;
VI Дуже жорстка – жорсткість більше 10 ммоль/дм3.
Різні країни умовно приймають свої одиниці. Так, 1 моль/м3 дорівнює 2,807 німецьких градусів, 5,005 французьких, 50,050 американських.
Вплив надлишкової жорсткості:Постійне вживання води з підвищеною жорсткістю призводить до зниження моторики шлунка, до накопичення солей в організмі, та, як підсумок, до захворювання суглобів (артрити, поліартрити) і утворення каменів в нирках і жовчних шляхах.М’яка вода вимиває з кісткової тканини солі. У людини може розвинутися рахіт (якщо пити таку воду з дитинства), у дорослої людини стає ламкою кісткова тканина. Є ще одна негативна властивість м’якої води. Вона, проходячи через травний тракт, не тільки вимиває мінеральні речовини, а й корисні органічні речовини, в тому числі і корисні бактерії.
1.1.2 Методика визначення
Трилонометричний метод
Трилон Б – двонатрієва сіль етілендіамінотетраоцтової кислоти, утворює міцні комплекси з іонами трьох- і двовалентних металів, зокрема з іонами кальцію і магнію
Схематично взаємодія трилону Б з іонами кальцію (магнію) згідно із рівнянням:
Ca2+Na2H2 R = Na2 (Ca R) = 2Н+,
де R — радикал етилендіамінотетраоцтової кислоти.
Трилонометричний метод використовують для вод із різною жорсткістю
Реактиви
- Розчин трилону Б 0,1 н.
- Аміачний буферний розчин.
- Індикатор еріохром чорний Т.
Хід визначення
У конічну колбу на 250 см3 відміряють піпеткою або циліндром 100 см3 досліджуваної води. Додають 5 см3 аміачного буферного розчину, 2-3 краплі індикатора еріохрома чорного Т (до появи інтенсивного вишнево-червоного кольору). Пробу титрують 0,1 н розчином трилону Б до зміни забарвлення в еквівалентній точці (забарвлення повинно бути блакитним із зеленуватим відтінком), стійким протягом 2 хвилин. Загальну жорсткість розраховують за формулою:
де Жзаг. – загальна жорсткість, ммоль/дм3; V1 – об’єм розчину трилону Б, що пішов на титрування проби, см3; Сн – нормальність робочого розчину трилону Б; V2 – об’єм проби води, см3
1.2 Визначення водневого показника рН
1.2.1 Загальна характеристика
Визначення кислотності у природній воді – визначення водневого показника.
Концентрацію іонів водню виражають величиною ![]() .
.
У більшості природних вод значення pH обумовлено лише співвідношенням концентрації вільної вуглекислоти і гідрокарбонат-іонів. В цьому випадку pH коливається від 4,5 до 8,3. Вода з підвищеним значенням рН може роздратовувати очі таі шкіру, викликати відчуття печії. При споживанні такої води шлунково – кишковий тракт стає вразливим для паразитуючих організмів. Вона може спровокувати багато захворювань.
Значне зниження рівня рН води також може заподіяти шкоди організму. Така вода позбавлена потрібних для нього речовин. Не отримуючи їх, тканини втрачають здатність до регенерації.Споживання кислої або лужної води призводить до порушення кислотно – лужного балансу, а, отже, порушується і його стабільне функціонування.Існує два основні методи визначення показника рН різних розчинів:
- Індикаторний метод. Визначення рН розчинів цим методом ґрунтується на тому, що індикатори змінюють своє забарвлення при різних значеннях рН, зокрема: метилоранж – при рН = 4,4; лакмус – при рН = 7; фенолфталеїн – при рН = 9.
- Метод потенціометра. Він заснований на вимірюванні ЕРС елемента, що складається з електрода порівняння (каломельний, хлорсрібний) і вимірювального електроду, потенціал якого є функцією активності іонів водню в розчині. Для цього використовують прилади: іономіри і рН-метри.
Основні технічні характеристики приладів, що використовуються в даній роботі:
- Іономер універсальний «ЕВ-74».
Напруга живлення: 220 В, частота струму 50 Гц. Іономір призначений для вимірювання активності іонів водню (рН), активності інших одновалентних і двовалентних аніонів і катіонів (рХ) в розчинах у вигляді аналогового сигналу напруги постійного струму. Прилад призначений для використання в лабораторіях науково-дослідних установ. Діапазон вимірювань рН в даній роботі: 4-9.
Шкала: 0,1-14,0 рН; шаг: 0,1; амплітуда температур: 0-50°С при відносній вологості менш ніж 95%. Табло: електронне монохромне
1.2.2 Методика визначення
1) Виконання вимірювань водневого показника іономером універсальним ЕВ-74
1. Іономер ЕВ-74 включаємо в мережу і прогріваємо 20 хв. для стабілізації роботи.2. Промиваємо електроди дистильованою водою, потім досліджуваною водою і занурюємо в аналізовану воду.3. Вимірюємо величину pH відповідно до інструкції, яка додається до приладу.4. Отримані результати округляємо до 0,05-0,1 одиниці pH.
2) Виконання вимірювань водневого показника портативним рН-метром
Занурюємо електрод в середу для вимірювань. Чекаємо, доки показання приладу стабілізуються (45-60 секунд).
1.3 Мінералізація (сухий залишок)
1.3.1 Загальна характеристика
Визначення мінералізації (сухого залишку) в хімічному аналізі має велике практичне значення. Ця величина дозволяє не тільки характеризувати загальну мінералізацію води, але й контролювати якість виконаного аналізу, тому що при вірно виконаному аналізі загальний вміст знайдених речовин повинен бути близький до величини сухого залишку.
У водах, а також у розсолах, сухий залишок отримують випаровуванням води з содою. У кислих водах сухий залишок отримують випаровуванням з сірчаною кислотою. Найбільш зручно обсяг води для визначення брати з таким розрахунком, щоб вага сухого залишку становила 50 – 500 мг. Для визначення сухого залишку в розсолах беруть наважку від 1 до 10 г в залежності від концентрації розсолу.
Визначення сухого залишку простим випаровуванням води і подальшим висушуванням при температурі 105 – 110 °С дає для вод і розсолів незадовільні результати внаслідок гідролізу і гігроскопічності хлоридів магнію і кальцію і важкою віддачі кристалізаційної води сульфатами кальцію і магнію. Ці недоліки усуваються додаванням до води, що випаровується, наважки хімічно чистого карбонату натрію. При цьому хлориди і сульфати кальцію і магнію переходять в безводні карбонати, а з натрієвих солей лише сульфат натрію має кристалізаційну водою, але вона повністю видалятися висушуванням сухого залишку при температурі 150 – 180 °С.Мінеральні води з певним змістом солей корисні для здоров’я, але лікарі рекомендують вживати їх в обмежених концентраціях. З іншого боку, ультрапрісна дистильована вода, що отримана внаслідок очищування води методом зворотнього осмосу, теж не дуже корисна для здоров’я – багато лікарів вважають, що її постійне вживання призводить до порушення сольового балансу і вимивання з організму необхідних хімічних речовин.
1.3.2 Методика визначення
Виконання вимірювання мінералізації портативним TDS-метром
Занурюємо прилад у середовище для вимірювання. Чекаєио, доки показання прибору стабілізуються (45-60 секунд).
2. Експериментальна частина
2.1. Визначення загальної жорсткості трилонометричним методом
Результати титрування:
|
№ п/п |
Об’єм проби води, V2, см3 |
Нормальність робочого розчину трилону Б, Сн, н |
Об’єм розчину трилону Б, що пішов на титрування*, V1, см3 |
Загальна жорсткість, Жзаг, ммоль/дм3 |
|
Проба 1 |
100 |
0,1 |
4,7 |
4,7 |
|
Проба 2 |
100 |
0,1 |
11,53 |
11,53 |
|
Проба 3 |
100 |
0,1 |
21,2 |
21,2 |
* Середнє значення 3-х паралельних дослідів
Розраховуємо загальну жорсткість:
Жзаг = (Vтр * Cтр *1000)/Vпробы
1 проба: Жзаг=(4,7*0,025*1000)/100=4,7 мг-екв/л
2проба: Жзаг=(11,53*0,025*1000)/100=11,53 мг-екв/л
3проба: Жзаг=(21,2*0,025*1000)/100=21,2 мг-екв/л
Висновок: згідно із санітарними правилами і нормами жорсткість питної води повинна бути не вище 7,0 мг-екв/л. Другий і третій зразок води, за даним показником, не відповідають нормі і небезпечні для вживання.
2.2. Визначення рН
Результати досліджень:
|
№ п/п |
Значення рН |
|
Проба 1 |
7,3 |
|
Проба 2 |
6,8 |
|
Проба 3 |
8,1 |
Висновок: згідно з санітарними правилами і нормами значення рН питної води не повинно перевищувати 6,5 – 8,5. Результати досліджень показали, що у всіх зразках води значення рН в межах норми.
2.3 Визначення мінералізації (сухого залишку)
Результати досліджень:
|
№ п/п |
Мінералізація (сухий залишок), мг/л |
|
Проба 1 |
286 |
|
Проба 2 |
722 |
|
Проба 3 |
2010 |
Висновок: в нормі сухий залишок питної води не повинен перевищувати 200-500 мг/л. В ході дослідження було виявлено, що мінералізація другого і третього зразків води перевищує норму. Отже, можна зробити висновок, що ця вода не придатна для вживання в питних цілях.
Висновки
Проблема якості питної води турбує людське суспільство протягом всієї історії його існування. В теперішній час питна вода – це проблема соціальна, політична, медична, географічна, а також інженерна та економічна.Питна вода – найважливіший фактор здоров’я людини. Практично всі її джерела під впливом антропогенного і техногенного впливу різної інтенсивності.В ході навчальної науково – дослідницької роботи були вирішені наступні завдання:- кількісно визначена загальна жорсткість (вміст іонів Mg 2+ і Ca 2+);- визначено водневий показник рН досліджуваної води;- кількісно визначена мінералізація досліджуваної води.
Таблиця – Показники хімічного складу води
|
Показник |
ДержСанПін 2874-82 |
Результати аналізу |
||
|
Проба 1 |
Проба 2 |
Проба 3 |
||
|
Загальна жорсткість, мг-екв/дм3 |
7(10) |
4,7 |
11,53 |
21,2 |
|
Водневий показник рН |
6,5 –8 ,5 |
7,3 |
6,8 |
8,1 |
|
Мінералізаці (сухий залишок), мг/дм3 |
200-500 |
286 |
722 |
2010 |
Порівнюючи отримані результати аналізів з вимогами ДержСанПін, можна сказати про те, що тільки 1-й зразок води повністю відповідає вимогам за всіма досліджуваними показниками.Для остаточного висновку про якість води не можна обмежуватися тільки представленими в роботі показниками. Існує цілий ряд хімічних, фізичних, санітарно-мікробіологічних параметрів, які також дуже важливі при оцінці якості води.
Перелік літератури
- Державні санітарні правила і норми «Вода питна. Гігієнічні вимоги до якості води централізованого господарсько-питного водопостачання». – К.: ІЖКГ Держбуду України, 1999. – 55с.
- Карюхина Т.А., Чурбанова И.Н. Химия воды и микробиология. – М.: Стройиздат, 1995. – 208 с.
- Кульский Л.А., Гороновский И.Т., Когановский А.М. и др. Справочник по свойствам, методам анализа и очистке воды. В 2 томах. – К.: “Наукова думка” , 1980. – 1206 с.
- Липунов И.Н. Основы химии и микробиологии природных и сточных вод. – Е.: УГЛТА, 1995. – 212 с.
- Набиванець Б. Й. Аналітична хімія природного середовища. – К.: Либідь, 1996. – 304 с.на Allbe
Редакція може не поділяти думку авторів і не несе відповідальність за достовірність інформації. Будь-який передрук матеріалів з сайту може здійснюватись лише при наявності активного гіперпосилання на e-kolosok.org, а також на сам матеріал!