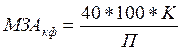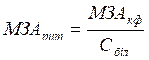Шкред Катерина Володимирівна.
Територіальне відділення
Малої академії наук України:
м. Волновахи.
Діанівська загальноосвітня школа І-ІІІ ступенів
Волноваської районної ради Донецької області.
8 клас. Село Діанівка.
Науковий керівник:
Шкред Ольга Володимирівна,
вчитель біології
Діанівської загальноосвітньої школи І-ІІІ стуненів
Волноваської районної ради Донецької області,
лауреатка V Всеукраїнського Інтернет-конкурсу
„УЧИТЕЛЬ РОКУ – 2020” за версією
науково-популярного природничого
журналу „КОЛОСОК” у номінації
„Біологія та основи здоров’я”.
ВСТУП
За кількістю і продуктивністю ензимів вищі гриби можна поставити на один рівень з мікроорганізмами, які застосовують в різних галузях промисловості (легка, харчова, медична та ін.) [2]. Вивчення протеолітичних ферментів вищих базидіальних грибів за останні роки помітно інтенсифікувалося. Однак, наявні публікації охоплюють досить вузьку систематичну групу грибів і стосуються, як правило, характеристики ферментних препаратів різного ступеня очищення.
Перед сучасної біотехнологією стоять завдання виявлення нових об’єктів і розробка наукових основ для отримання кормового і харчового білка, а також біологічно активних речовин (БАР). Необхідність їх вирішення обумовлена, зокрема, недоліком цілого порядку біологічно активних речовин, які використовуються в різних галузях промисловості та медицини. До них відноситься реннін – молокозсідальний сичужний фермент, який використовують під час виробництва сиру для зсідання молока. Виробництво ферменту лімітується рівнем розвитку тваринництва і вимагає пошуку нових нетрадиційних продуцентів [1,4,7].
Отримання цінних грибних метаболітів пов’язано з підбором умов для їх синтезу під час культивування є одним із головних завдань біотехнології.
Дослідження молокозсідальних ферментів афіллофорових грибів пояснюються в першу чергу тим, що виникає дефіцит сировини тваринного походження – основного джерела промислових протеаз. У той же час молокозсідальні ферменти афіллофорових грибів є позаклітинними (екзоферменти), що є суттєвою перевагою для отримання їх в умовах біотехнологічного виробництва [4,5,6].
Метою даної роботи було дослідження впливу умов культивування на молокозсідальну активність гриба Tv-1 Trametesversicolor (L.) Pilat.
Мета досягалася рішенням наступних завдань:
• вивчення динаміки протеолітичної активності базидіального гриба Tv-1 T. versicolor в залежності від доби культивування;
• вивчення динаміки накопичення біомаси та концентрації білка, а також зміни рН культурального середовища протягом культивування гриба;
• вивчення впливу початкового рівня кислотності середовища на загальну і питому молокозсідальну активність гриба Tv-1 T. versicolor;
• вивчення впливу початкового рівня кислотності середовища на накопичення біомаси грибом, зміни концентрації білка в культуральному фільтраті Tv-1 T. versicolor.
РОЗДІЛ 1. АНАЛІЗ НАУКОВОЇ ЛІТЕРАТУРИ З ПРОБЛЕМИ ВИКОРИСТАННЯ БАЗИДІОМІЦЕТІВ ЯК ПРОДУЦЕНТІВ БІОЛОГІЧНО АКТИВНИХ РЕЧОВИН
1.1. Вищі базидіоміцети як продуценти біологічно активних речовин.
Останнім часом вищі гриби стали предметом дослідження багатьох фахівців. Цей інтерес пояснюється значними успіхами в галузі вивчення процесів метаболізму у грибів в цілому, і прогресу в технічному оснащенні процесів культивування, створенням колекцій чистих культур грибів і можливістю їх широкого практичного використання. Гриби мають дуже різноманітне господарське значення. Багато з них дуже широко використовуються в практичній діяльності людини. У наш час інтенсивно досліджується здатність грибів до синтезу різноманітних сполук [1,4].
В останні роки спостерігається помітний сплеск уваги до пошуку і вивчення біологічно активних сполук серед вищих базидіоміцетів, а також створення на основі грибів і продуктів їх метаболізму харчових і кормових добавок, а також лікарських препаратів [9,12,13].
Базидіоміцети є джерелом природних БАР – біологічно активних речовин. Проблема вивчення БАР не нова, але й досі актуальна. Це пов’язано з можливістю встановлення корисних властивостей грибів, пошуком нових хімічних сполук, вивченням закономірностей метаболічних шляхів БАР і їх спрямованої регуляції, встановленням біологічної ролі активних метаболітів і, врешті-решт, широким застосуванням їх в медицині і господарстві [12].
Можливість використання грибів для створення фармацевтичних препаратів профілактичного і лікувального значення стала реальною після багаторічних фундаментальних досліджень процесів життєдіяльності макроміцетів, в тому числі особливостей їх росту і розвитку, характеру і механізмів метаболічної та ферментативної активності.
Це підтверджує також давня історія експериментальних досліджень природи біологічної активності вищих грибів та їх метаболітів. Розпочаті в 50-х роках минулого століття широкий пошук і вивчення біологічно активних сполук серед рослин і мікроорганізмів не могли залишити поза увагою вищі гриби. З цього часу тисячі зразків та їх метаболітів були включені в дослідження [1,7,12].
Довгі роки інтерес досліджень природних сполук будь-якого походження, будь то гриби, мікроорганізми або рослини, був пов’язаний з пошуком нових хімічних структур. Однак останнім часом значно важливіше і вимога виявилися властивості природних сполук і перш за все рівень і характер їх біологічної активності [2,7,12].
За останні роки кілька тисяч штамів вищих грибів, які належать до порядків Agaricales, Aphillopharales, Gasteromyces, вивчені на біологічну активність, при цьому випробуванню піддавали екстракти з плодових тіл і міцелію, культуральні фільтрати, а також індивідуальні грибні метаболіти. Застосування сучасних методів дозволило вивчити характер біологічної дії метаболітів і встановити структуру багатьох цих речовин.
Профілактичні і лікувальні препарати з базидіоміцетів сприяють адаптації людини до несприятливих умов, прискорюють виведення з організму радіонуклідів, важких металів, різноманітних токсинів.
У базидіоміцетів знайдені речовини, які стимулюють імунну систему, мають протипухлинну, антибактеріальну, противірусну та протигрибкову дію, в тому числі антіСНІДову активність, здатні регулювати кров’яний тиск, знижувати вміст холестерину і цукру в крові та ін.
В лікувально-оздоровчих препаратах на основі їстівних грибів не виявлено небажаних побічних ефектів та токсичної дії. Так, наприклад, протиракова активність виявлена у багатьох видах базидіоміцетів з родів Agaricus, Auricularia, Boletus, Coriolus, Calvatia, Captinus, Flammulina, Grifola, Pholiota, Tricholoma і ін. [2].
Крім того, було встановлено, що деревинноруйнівні гриби, які викликають буру гниль деревини, здатні утворювати щавлеву кислоту і накопичувати її в середовищі при вирощуванні в штучної культурі, що може становити інтерес для отримання її в промислових цілях. Мікроскопічні гриби синтезують великий набір ферментів, який дозволяє перетворювати на харчовий білок відходи виробництва паперу, текстильної промисловості, харчового виробництва і тощо. Вищі гриби також здатні у величезних кількостях синтезувати ферменти[5,7].
Ферменти або ензими, специфічні каталізатори, присутні у всіх живих клітинах. Ферменти являють собою органічні речовини, вироблені живими клітинами, вони ініціюють і регулюють специфічні хімічні реакції всередині або поза живих клітин, при цьому хімічна структура самих ферментів не підвергається будь-якої зміни.
Практичне значення ферментів дуже велике. Ферментативні процеси є основою багатьох виробництв: хлібопечення, виноробства, пивоваріння, сироваріння, виробництва спирту, чаю, оцту. З початку XX століття за пропозицією японського вченого Такаміне в спиртовій та інших галузях промисловості почалося застосування ферментних препаратів, одержуваних з цвілевих грибів або бактерій.
У ряді країн цей спосіб широко використовується для оцукрювання, за допомогою амілаз крохмалистої сировини з метою отримання кристалічної глюкози або його зброджування на спирт. Концентровані амілолітичні препарати ферментів з цвілевих грибів при добавці в тісто приводять до поліпшення якості хліба і прискорення технологічного процесу. Препарати протеолітичних ферментів, одержуваних з грибів, застосовуються в шкіряної промисловості для видалення волосся і пом’якшення сировини, а в сироробній промисловості для заміни дефіцитного сичужного ферменту (реніну). Препарати мікробних пектологічних ферментів широко використовують при виробництві соків (вихід соку підвищується на 10 – 20%). Виняткову роль ферменти відіграють в медицині. Застосування ферментів грибного походження і вивчення їх ферментативних процесів допоможе відкрити нові продуценти, а також дозволить в подальшому розширити сферу їх застосування і відкриє додаткові можливості, а в подальшому, можливо, допоможе позбутися від багатьох хвороб і полегшить фінансові проблеми пов’язані з використанням ферментів в харчовій і легкої промисловості.
Серед макромолекулярних метаболітів грибів з високою біологічною активністю поруч з полісахаридами представляють інтерес також лектини і ферменти.
Хоч наявність у вищих грибів різних гідролітичних і окислювальних ферментів відзначали багато дослідників, проте їх структура і функції практично не були встановлені в плоть до кінця 70-х років минулого століття.
Вивчення ферментативної активності вищих грибів становить значний науковий інтерес, так як дозволяє зрозуміти специфіку метаболічних процесів і адаптаційні потенції цих організмів. У той же час вивчення ферментів має важливе практичне значення, так як для більшості грибів характерний синтез екзоферментів – гідролаз і оксидаз, який надзвичайно необхідний в медицині і промисловості. Біосинтез ферментів може бути індукований як умовами культивування, так і за рахунок генетичних маніпуляцій.
Н. П. Денисова розглянула результати вивчення протеїназ у вищих грибів. Відзначено, що дослідження протеолітичних ферментів базидіальних грибів спрямоване на пошук активних продуцентів специфічних протеїназ (молокозсідальної, фібринолітичних і ін.) І встановлення характеру розподілу їх в таксономічних та екологічних групах базидіоміцетів. В даний час доведено, що багато видів агарикових і афілофорових грибів декретують екзопротеїнази, які гідролізують складні субстрати – гемоглобін, желатин, казеїн, молоко, фібрин. Це пов’язано з наявністю в грибах різних типів протеїназ. Вивчення характеру поширення їх в базидіоміцети показало, що більшість лігнін руйнівних грибів активно синтезують карбоксильні протеїнази і металопротеїнази. У меншій мірі характерний для базидіомітів синтез тіолових і сері нових протеїназ [9,10].
Основними продуцентами протеїназ, які мають фібріно- і тромболітичну дію, гостродефіцитних в медицині, є різні групи мікроорганізмів – бактерії і актиноміцети. Дослідження базидіоміцетів, які культивували на рідкісних середовищах, показали їх здатність продукувати також специфічні екзопротеїнази. Гриби з родів Coprinus, Flammulina P.Karst. і інші були запропоновані в якості активних продуцентів фібринолітичних ферментів.
Цілеспрямований пошук продуцентів молокозсідальних ферментів серед макроміцетів показав, що як агарикові так і афілофорові гриби синтезують ці специфічні протеїнази. Ряд штамів грибів з родів Cerrena, IrpexFr., RussulaPers. та інші запропоновані для отримання ферментів, які застосовуються у виробництві сирів [10].
Використання їстівних макроміцетів, вирощених на рідкісних поживних середовищах, як продуцентів специфічних протеїназ дозволяє комплексно утилізувати міцелій і екзоферменти.
Отже, вивчення біосинтетичної активності базидіоміцетів, їх низькомолекулярних і полімерних метаболітів призвело до відкриття різних структур природних складів, в тому числі і специфічних ферментів, які значно поповнили асортимент біологічно активних речовин. Широке поширення базидіальних грибів в природі і можливість культивування їх на рідкісних поживних середовищах відкривають широкі можливості як для пошуку нових джерел БАР, так і для нетрадиційного використання цієї групи організмів в різних областях промисловості і медицини [7].
У країнах СНД цілеспрямовані дослідження по інвентаризації біоти макроміцетів, а також щодо збереження, підтримки і вивчення базидіоміцетів exsitu, вжиті в зв’язку з виконанням програми по «Біологічному різноманітності», надають нові можливості для пошуку біологічно активних сполук серед вищих грибів. Залучення в орбіту досліджень рідко зустрічаються, зі складною трофікою і екологією грибних організмів не тільки дозволить розширити пошук, але і сприятиме отриманню нової інформації по їх біології, хімії та генетики [13].
1.2. Вплив складу живильного середовища на фізіологічні особливості базидіальних грибів.
Вирощування вищих грибів в штучних умовах вимагає вивчення їх відносин до факторів зовнішнього середовища, які регулюють накопичення біомаси або бажаних продуктів метаболізму. Вивчення поживних потреб дозволяє встановити фізіологічні особливості певних штамів, а також використовувати отримані результати в подальших роботах по оптимізації поживних середовищ субстратів для подальших досліджень.
Одним з найважливіших факторів, які регулюють ріст і метаболізм вищих базидіальних грибів в культурі, є рН живильного середовища. Концентрація водневих іонів в середовищі впливає на характер метаболічних процесів. У зв’язку з цим необхідно попередньо встановити ті кордони рН, в яких відбувається зростання досліджуваних штамів. З огляду на те, що оптимальна рН середовища буде різною на різних середовищах [3,8].
Також необхідно враховувати склад живильного середовища на якому планується культивування певного штаму. Це пов’язано з джерелами вуглецевого і азотного живлення для різних видів грибів.
Як відомо, мікоризні гриби, так само як і гриби інших екологічних груп базидіоміцетів, можуть пристосовуватися до різних джерел вуглецевого живлення. Вони здатні засвоювати нехарчові цукри, такі як пентози, галактози, полісахари типу геміцелюлоз. Найчастіше джерелом вуглецю для базидіальних грибів є полімерні форми простих цукрів. Зазвичай хороший ріст грибів відзначався на середовищах з глюкозою. Глюкоза включається в обмін набагато швидше, ніж інші цукри. Легко засвоюються грибами також цукри, близькі за будовою до глюкози, наприклад галактоза. З дисахаридів гриби добре утилізують целюлозу і мальтозу, які в природі зустрічаються як продукт розщеплення крохмалю.
Карбоновмісні субстрати грають головну роль в харчуванні грибів, забезпечуючи грибний організм вуглецем, необхідним для синтезу речовин живої клітини і участі в процесах окислення, де він є єдиним джерелом енергії. Вищі базидіоміцети, які представляють собою різні екологічні групи, стикаються в природі з великою різноманітністю вуглеводів, найчастіше з полімерними формами простих цукрів. При штучному культивуванні вони віддають перевагу іншим цукрам джерел вуглецю. Існує думка, що глюкоза є універсальним джерелом вуглецю для всіх вищих базидіоміцетів, хоча вона не завжди забезпечує максимальний ріст міцелію. Для більшості базидіальних грибів таким же гарним джерелом вуглецю, як глюкоза, служить фруктоза. Найкращим джерелом вуглецю для багатьох базидіоміцетів є крохмаль. Базидіоміцети в природі беруть участь в розкладанні целюлози і добре використовують цей високомолекулярний вуглевод при штучному культивуванні. Лігнін використовується багатьма деревиноруйнівними грибами в природі. Однак в культурі для засвоєння грибами він повинен знаходитися в доступній формі, і гриби, як правило, повинні бути до нього адаптованими [5].
Здатність грибів засвоювати вуглеводи з різних джерел істотно впливає на їх розвиток і фізіологію. Наявність і співвідношення компонентів харчування в середовищі, перш за все джерел вуглецю і азоту, можуть значно відображаються на біосинтезі ферментів. Різні джерела вуглецю по-різному засвоюються грибами. Здебільшого гриби добре засвоюють вуглеводи, спирти, органічні кислоти. Є гриби, які споживають тільки певні вуглецеві сполуки: одні види – глюкозу, інші – фруктозу, мальтозу.
Гриби часто відзначаються неоднаковою потребою в різних джерелах вуглецю для розвитку міцелію, формування плодових тіл, накопичення метаболіту.
Можливість використання того або іншого з’єднання в якості джерела вуглецю для грибів визначають за різними показниками: максимальним наростанням міцелію, накопиченням біомаси та метаболізму в середовищі. Про придатність певного з’єднання свідчить не тільки рівень наростання міцелію, але і час його максимального накопичення.
Вибір джерела азоту дуже важливий для отримання красивого міцелію в культурі і високому вмісті в ньому протеїну. Потреба грибів в азоті в значній мірі залежить від постачання їх вуглецем, а також від інших факторів. Вищі базидіоміцети можуть використовувати як неорганічні, так і органічні форми азоту. Основним джерелом азоту є амонійні солі та нітрати. На думку деяких вчених, нітрати добре засвоюються багатьма вищими базидіоміцети. Органічний азот зазвичай забезпечує кращий ріст міцелію, ніж мінеральні солі азоту. Як одне з сприятливих джерел азоту відзначають аспарагін [11]. Хорошим джерелом для базидіальних грибів також є білки, пептони, вільні амінокислоти, гідролізат казеїну.
1.3. Протеїнази вищих базидіоміцетів.
При оцінці протеолітичної активності (ПА) в якості субстратів Д.Я., Петіна Т.А., Імшенецький А.А., Броцька С.Е., Фаліна М.М., Денисова Н.П. використовували фібринові плівки, тромби крові, а при вивченні базідіом- додатково казеїн і молоко, тобто оцінювали фібринолітичну (ФА), тромболітичну (ТА), казеїназну (КА), молокозсідальну (МЗА) активність [19, 24]. Аналіз розподілу ПА в різних систематичних групах агарикових макроміцетів [3,8, 13,14] показав, що вираженим біосинтезу протеїназ різної субстратної специфічності характеризуються переважно сімейства Pleurotaceae (пологи Pleurotus, Panus), Tricholomataceae (пологи Lepista, Lyophyllum, Flammulina, Armillaria, деякі види роду (Psathyrella ), Bolbitiaceae. Для ряду родин – Amanitactae, Cortinariaceae, Strophariaceae, Russulaceae, до складу яких входять переважно симбіотичні види, характерні низькі значення або відсутність активності досліджуваних ферментів. у групі афіллофорових грибів [14] на більшу кількість культур з активним біосинтезу протеїназ зосереджено в сімействі Polyporaceae (переважно види, що викликають корозійну гниль деревини). Дослідження Карпофора класу Basidiomycetes показали, що в цілому близько третини видів характеризувалися вираженим біосинтезу протеїназ, що атакують казеїнові і фібринові білки. Таким чином, активним біосинтезу досліджуваних протеїназ характеризувалися певні таксономічні групи базидіоміцетів, що дозволило надалі вести цілеспрямований пошук продуцентів цих ферментів [4,6,13].
При вивченні каталітичного центру ферментів шляхом блокування активності різними інгібіторами було показано, що базидіоміцети синтезують всі чотири відомих типу протеїназ- аспариільні (або карбоксильні, кислі), серинові, тіолові і металлопротеїнази. За літературними даними, ступінь вивченості цих типів ферментів різна. У зв’язку з високою молокозсідальною активністю найбільш досліджені аспартильні протеїнази [12].
Властивості карбоксильних протеїназ базидіоміцетів виявилися близькі карбоксильним протеїназам мікроміцетів. Значно менше вивчені металлопротеїнази, ще слабше- тіолові і зовсім не досліджені серинові протеїнази базидіоміцетів. Шагінян К.А. та ін. вперше виділили і охарактеризували серед нових протеїназ з культури роду Coprinus. Виявилося, що за фізико-хімічними властивостями серинові протеїнази вищих базидіоміцетів є досить близьким аналогом сері нових протеїназ мікроорганізмів і рослин, зокрема з листя соняшнику, і близька протеїназа сімейства субтилізина. Це має принципове значення, так як може вказувати на зв’язок між сериновими протеїназами мікроорганізмів, вищих грибів і рослин. При вивченні металопротеїназ з роду Flammulina, Coprinus, Cerrena Антонов В.К. і Псурцева Н.В. виявили, що каталітичний центр цих ферментів містить атоми цинку, як це спостерігається у більшості інших металопротеїназ різних про- і еукаріотів [13,14].
Досліджувані комплекси протеїназ, синтезовані базидіоміцети різних систематичних та екологічних груп, розрізнялися поєднаннями в них чотирьох типів протеїназ. Встановлено, що у ксилотрофів з родів Flammulina і Cerrena основний внесок в фібринолітичну активність вносять металопротеїнази і незначні аспартильні протеїнази. У сапротрофов, зокрема копротрофов з роду Coprinus, виявлений більш широкий спектр металопротеїнази, серинових і незначна активність аспартільних і тіолових або сері нових тіол залежних протеїназ. Отримані ферментні комплекси поряд з високою фібріно- і тромболітичної активністю володіли вираженою молокозсідальною активністю. У 80-і роки групою французьких дослідників [15] було показано, що первинна структура казеїну і фібриногену має великий відсоток ділянок з гомологічною амінокислотною послідовністю. У зв’язку з цим стає зрозумілим, чому протеїнази базидіоміцетів (так само як і інших організмів) можуть одночасно з високою ФА проявляти і високу МЗА. Лише в разі біосинтезу протеїназ з більш вузькою субстратною специфічністю, спрямованої на гідроліз пептидних зв’язків, розташованих поза гомологічних ділянок, слід очікувати виділення ферментних препаратів з роздільним фібринолітичним і молокозсідальним ефектом. При вивченні специфіки дії протеїназ деяких базидіоміцетів Морозова Е.Н. та ін. Показали, що F. velutipes, наприклад, синтезує протеїнази з високою швидкістю гідролізу пептидного зв’язку Gly-Phe і Gly-Val [29] Аналогічно специфічність була виявлена для Pleurotuscornucopiae і Lyophyllumfumosum [48]. Знаючи субстратне специфічність базидіальних протеїназ і маючи дані про первинну структуру зазначених субстратів, можна передбачити про наявність фібринолітичної активності у певних видів базидіоміцетів.
Таким чином, виявлена залежність ПА базидіоміцетів від наявності в середовищі супероксидних радикалів, а також виявлена здатність протеїназ брати участь в регуляції активності целюлаз і оксидаз, мимоволі призводить до уявлення про існування у деяких груп базидіоміцетів сполученого дії цих ферментів. На основі їх координованих взаємодій, мабуть, відбувається освоєння в природі лігноцелюлозних субстратів. При аналізі характеру розподілу протеїназ з вираженим фібринолітичним ефектом в різних систематичних групах базидіоміцетів переважна більшість видів серед афіллофорових відносилося до ксилотрофів, що викликають білу гниль деревини, а серед агарікових- до таксонам, які віддають перевагу деревні або багаті органікою субстрати. В тому і іншому випадку ці субстрати включали лігноцелюлозні з’єднання різного ступеня деструктивності. Денисова Н.П. і ін. не беруть на себе сміливість ставити питання про еволюційну присутність зазначених груп базидіоміцетів. Щоб судити про філогенетичне значення обговорюваної ознаки, важливо зрозуміти, якому тиску з боку еволюції він міг піддаватися. Можна лише припустити, що в ході еволюції базидіоміцетів, у яких відзначені високі рівні ФА і ТА, зберігся або закріпився і отримав подальший розвиток більш мобільний шлях регуляції ферментної системи, що може бути відображенням рівня ідіоадаптації цих таксонів.
Отримані Денисової Н.П. експериментальні дані по структурі протеїназ базидіоміцетів і їх можливої біологічної ролі послужили науковим фундаментом при створенні банку даних по протеолітичної активності вищих грибів з класу Basidiomycetes. В результаті були відібрані штами, що активно синтезують протеїнази. Для ряду продуцентів розроблені оптимальні склади живильних середовищ з використанням методів математичного планування. Ферментні препарати, отримані з різних базидиомицетов, мали високу фібринолітичну активність.
РОЗДІЛ 2. ОРГАНІЗАЦІЯ ЕКСПЕРИМЕНТАЛЬНОГО ДОСЛІДЖЕННЯ УМОВ КУЛЬТИВУВАННЯ НА МОЛОКОЗСІДАЛЬНУ АКТИВНІСТЬ ГРИБА Tv-1 Trametesversicolor (l.) pilat
2.1. Об’єкт дослідження.
Об’єктом дослідження було обрано культуру Tv-1 деревинноруйнуючогосапротрофного гриба Trametesversicolor (L.) Pilat. (Рис.2.1).
Даний гриб належить до родини Coriolaceae. Має тонке, шарувате плодове тіло з різнокольоровими зонами сірого або коричневого відтінків характерних для цього гриба, з бархатистою поверхнею і нерівним краєм, іноді розпростерте. Розміри плодового тіла 2-7х1-5 см, товщиною 1-5 мм. Плодове тіло однорічна, але може рости навесні і далі. Щільно прикріплений вузькою зоною до субстрату трутовик широко опахолоподібний. Трубчастий шар товщиною до 3 мм, білий, при підсиханні світло-жовтий, з 3-4 порами на 1 мм. Жорстка м’якоть біла. Дрібний екземпляр, типової форми, зони сірі і темні синювато-сірі. Спори великі, до 8 мкм довгою, циліндричні Мешкає на деревах твердих порід в лісах, парках і садах, викликає білу гниль. Дуже звичайний всюди в північній помірній зоні. Неїстівний [13, 25].
2.2. Методи дослідження.
Для виділення культур з плодових тіл використовувалася загальноприйнята методика [3,8]. Попередньо очищене від частинок ґрунту, листя та кори плодове тіло розрізали на фрагменти 5х5 мм. Фрагмент тканини стерильним мікологічним гачком (обробленим над полум’ям спиртівки) вносили в 5-10% розчин H2O2 і витримували 1-2 хвилини. Потім над полум’ям спиртівки оброблений фрагмент тканини за допомогою мікологічного гачка вносили в пробірки (20 × 210 мл). Чашки з інокулюму поміщали в термостат при температурі 25° С. Чистий грибний міцелій з’являвся через 3-4 дня. При появі міцелію частину його переносили в іншу пробірку з живильним середовищем. Щоб уникнути зараження зразка, робили кілька переносів.
Культивування проводили на картопляно – глюкозному агарі такого складу: картопля – 250 г. (використовується відвар очищеної картоплі), агар – агар – 9 м, глюкоза – 10 м, дистильована вода до 1 л. Середу доводили до однорідної густої рідини [14].
Культивування грибів проводили поверхневим способом на рідкому глюкозо – пептонному живильному середовищі наступного складу (г / л): глюкоза – 10,0, пептони – 3,0, К2НРО4 – 0,4, КН2РО4 – 0,6, MgSO4х7H2O – 0,5, ZnSO4х7H2O – 0,001, CaCl2 – 0,05, дистильована вода до 1 л. Середу розливали в колби Ерленмейера (250 мл), в кількості 50 мл і автоклавувалися в автоклаві АГ-1 протягом 45 хвилин при 1,0 -1,1 атм. Остигнуте стерилізоване живильне середовище інокулювують шматочками міцелію досліджуваного штаму гриба.
Метод культивування на поверхні рідких живильних середовищ дуже зручний для найрізноманітніших експериментальних досліджень. Він дозволяє отримати багато цінних даних, вивчити вплив різних чинників на розвиток певного виду гриба, отримати дані для попереднього визначення його біохімічних властивостей.
Рівень кислотності середовища до культивування і після визначали потенціометричним методом на рН -метрі «рН-340». До потрібного рівня кислотність доводили за допомогою 10% – го розчину HCl.
Молокозсідальну активність культуральних фільтратів штамів грибів визначали за методом Каваї і Мукаї [3]. Метод заснований на визначенні часу, протягом якого відбувається зсідання молока. Отримані значення переводили в умовні одиниці за формулами:
40 – середній час (у хвилинах) зсідання молока, при виробництві сиру; К – коефіцієнт розведення культурального фільтрату; П – час (у хвилинах), за яке з 100 мл молока при додаванні 1 мл культурального фільтрату або 1 мл 0,1% розчину ферменту утворився щільний згусток. Питому молокозсідальну активність визначали за формулою:
МЗАкф – молокозсідальна активність культурального фільтрату (од/мл), Сбіл – концентрація білка в 1 мл культурального фільтрату (мг/ мл).
У процесі культивування гриби виділяли в середу молокозсідальний фермент. Про ступінь активності ферменту судили за часом звурджування молока в хвилинах. Час, необхідний для утворення щільного згустку молока, вимірювали секундоміром.
Субстратом служило свіже натуральне молоко з додаванням 1 мл 15% розчину CaCl2 х 2Н2О на кожні 100 мл молока. Кислотність субстрату доводили до 6,00 – 6,05 за допомогою 10% – го розчину HCl [8].
Кількість білка визначали спектрофотометричним методом, на спектрофотометрі «СФ – 26». Оптичну щільність вимірювали при довжині хвилі 260 і 280 нм. Для розрахунку користувалися формулою (мг / мл):
З = 1,55 * А280-0,76 * А260.
Накопичення біомаси визначали ваговим методом. Отриманий міцелій відціджували в попередньо зважені бюкси і поміщали їх в сушильну шафу з температурою 1050 С на 24 години. Потім бюкси з сухим міцелієм зважували на аналітичних вагах і обчислювали масу сухого міцелію.
Отримані дані обробляли статистичним методом за допомогою дисперсійного аналізу. Порівняння середніх величин проводили за методом Дункана [34]. За допомогою однофакторного дисперсійного аналізу ми вивчили вплив фактора доби на зміну концентрації білка, рН культурального фільтрату і приріст біомаси. Всі градації фактора досліджувалися при однакових умовах.
2.3. Результати досліджень та їх обговорення
2.3.1.Динаміка зміни загальної молокозсідальної активності культурального фільтрату Tv-1 Trametesversicolor (l.) Pilat
В ході експерименту ми визначили динаміку молокозсідальної активності культурального фільтрату Tv-1 Trametesversicolor (l.) Pilat (рис. 3.1). Дослід проводили протягом 30 діб в 3-х повторностях.

Рис.3.1. Динаміка загальної молокозсідальної активності культурального фільтрату Tv-1 Trametesversicolor (l.) Pilat
Дісперсійний аналіз показав достовірність впливу фактора «доба» на загальну МЗА культурального фільтрату. Спостерігається поступове збільшення активності ферменту. На 5 добу молокозсідальна активність не була встановлена, але до 10 добу вона вже склала 200 од/мл. Абсолютний максимум активності був визначений на 25-30 добу і становив в середньому 307 од / мл.
2.3.2. Динаміка зміни питомої молокозсідальної активності культурального фільтрату Tv-1 Trametesversicolor (l.) Pilat
Статистична обробка отриманих даних дозволила встановити достовірність впливу фактора «доба» на питому молокозсідальну активність культури Tv-1 Trametesversicolor (l.) Pilat. Динаміка питомої молокозсідальної активності представлена на малюнку 3.2.
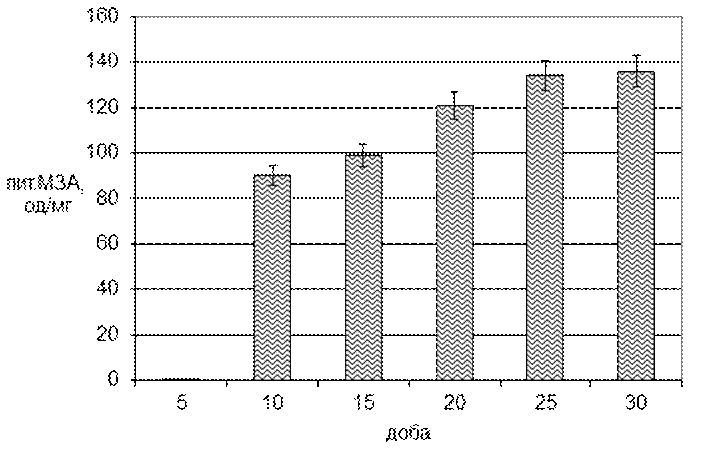
Рис. 3.2. Динаміка питомої молокозсідальної активності культурального фільтрату Tv-1 Trametesversicolor (l.) Pilat
Графік зміни питомої молокозсідальної активності за своїм характером розташування нагадує попередній графік загальної МЗА культури Tv-1 Trametesversicolor (l.) Pilat. Так на 5 добу культивування питомої активності в культуральнії рідині не спостерігається, на 10 добу питома МЗА значно зростає до 90 од / мг білка. Надалі спостерігається поступове збільшення значення до 135 од / мг на 25-30 добу.
2.3.3. Динаміка накопичення біомаси досліджуваної культурою Tv-1 Trametesversicolor.
Як було встановлено раніше максимум молокозсідальної активності у культури Tv-1 спостерігається на 25-30 добу, а взявши до уваги дані накопичення біомаси ми можемо констатувати, що синтез ферментів МЗ дії приходить на експонентну фазу зростання.
2.3.4. Зміна кислотності живильного середовища культурою Tv-1 Trametesversicolor (l.) Pilat
Дисперсійний аналіз показав достовірність впливу фактора «доба» на зміну рН живильного середовища після культивування гриба Tv-1 Trametesversicolor. Загальна картина зміни кислотності живильного середовища при культивуванні ізоляту Tv-1 представлена на малюнку 3.4.
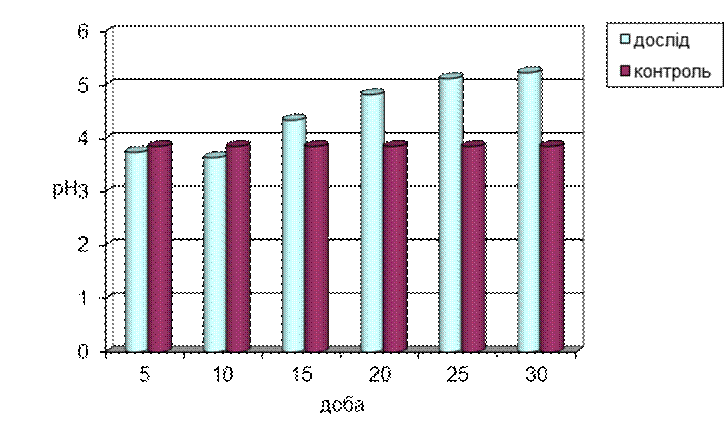
Рис.3.4. Зміна рН живильного середовища культурою Tv-1 Trametesversicolor (l.) Pilat в залежності від доби культивування.
Протягом перших 10 діб кислотність живильного середовища достовірно не відрізнялася від контролю (рН вихідної середовища після стерилізації). Далі спостерігається поступове підвищення лужності середовища до значення 5,2 на 25-30 добу. Протягом усього експерименту кислотність живильного середовища знаходиться в кислій зоні, а це побічно вказує на те, що грибом виділяються в культуральну рідину речовини, які мають кислу природу.
2.3.5. Динаміка загальної молокозсідальної активності штаму Tv-1 Trametesversicolor (l.) Pilat в залежності від значення стартового рН живильного середовища і доби культивування.
В ході подальших експериментів вивчався вплив початкової кислотності живильного середовища на здатність культури Tv-1 Trametesversicolor (l.) Pilat синтезувати протеїнази молокозсідальної дії. Стартова кислотність поживних середовищ доводилася до значення 3, 4, 5 і 6 рН. Дослід проводили протягом 30-ти діб. Показання знімали через кожні 5 діб. Отримані дані представлені на малюнку 3.5.
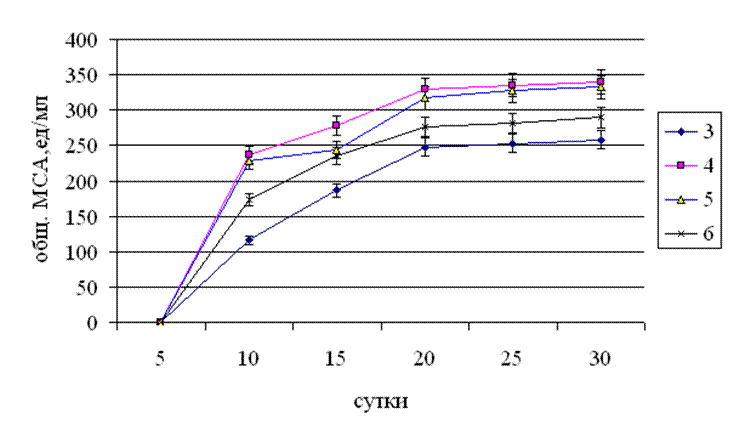
Рис.3.5. Динаміка загальної молокозсідальної активності культурального фільтрату штаму Tv-1 Trametesversicolor на середовищах з різним значенням рН живильного середовища.
Двофакторний дисперсійний аналіз показав достовірність впливу фактора «доба» і «кислотність живильного середовища» на загальну МЗА культурального фільтрату Tv-1 Trametesversicolor (l.) Pilat.
На 5-у добу культивування гриба ні при одному значенні рН живильного середовища молокозсідальна активність не виявлялася, що можна пояснити недостатнім накопиченням ферменту “сичужного” дії на цьому періоді культивування. Мінімальні значення МЗА при всіх значеннях рН живильного середовища були відзначені на 10-ту добу культивування і склали при рН 3 – 116 од / мл, при рН 4 – 236 од / мл, при рН 5 – 228 од / мл, при рН 6 – 173 од / мл. Абсолютно максимальні значення молокозсідального ферменту спостерігалися також одночасно при всіх значеннях рН живильного середовища на 20-30-у добу культивування і становили при рН3 – 252 – 258 од / мл, при рН4 – 335 – 340 од / мл, при рН5 – 327- 332 од / мл і при рН6 – 281- 289 од / мл. Протягом усього періоду культивування штаму було відзначено кілька стрибків в підвищенні МЗ активності між 15-ю та 20-ю добою цілодобового культивування при рН 5 і між 10-ю та 15-ю добою цілодобово при рН 6. При стартовому значенні живильного середовища рівного 3 можна відзначити досить різке підвищення молокозсідальної активності з 10-ої по 20-ої доби. Починаючи з 20-ої доби культивування і по 30-у активність ферментів залишалася незмінною. Звертає на себе увагу, той факт, що початкове значення рН живильного середовища на рівні 4 показало найсприятливішу дію на активність протеїназ молокозсідальної дії.
2.3.6. Динаміка питомої молокозсідальної активності штаму Tv-1 Trametesversicolor (l.) Pilat залежно від значення стартового рН поживного середовища і доби культивування.
Дісперсійний аналіз показав достовірність впливу фактора “доба” і “кислотність поживного середовища” на питому молокозсідальну активність штаму Tv-1 Trametesversicolor (l.) Pilat. Як видно з малюнка 3.6 на 5-у добу культивування штам Tv-1 Trametesversicolor (l.) Pilat не проявив здатності до зсідання молока, що пояснюється недостатнім накопиченням ферменту молокозсідальної дії в цей період. При стартовому значенні поживного середовища рівної рН 3 ми бачимо активне накопичення молокозсідального ферменту в період з 10 по 20 добу культивування. Потім з 20 по 30 добу активність залишалася достовірно на одному рівні.
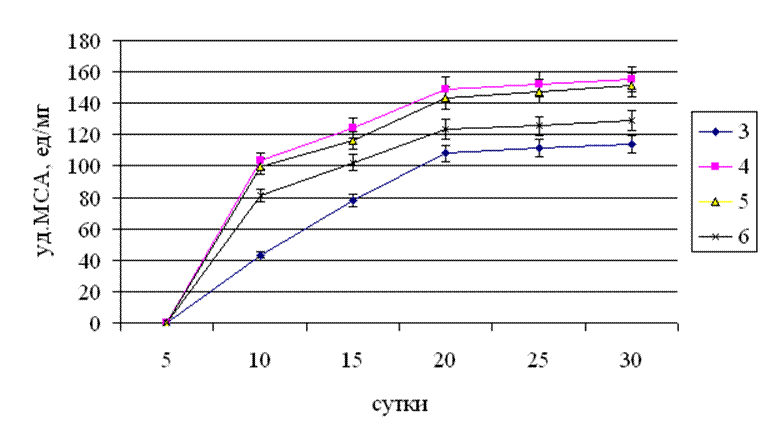
Рис.3.6. Динаміка питомої молокозсідальної активності культурального фільтрату штаму Tv-1 Trametesversicolor (l.) Pilat на середах з різним значенням рН поживного середовища.
При стартовому значенні рН поживного середовища рівного 4 спостерігався різкий стрибок в підвищенні МЗА на 20 добу культивування. Це говорить про те, що при цьому значенні рН саме в цей період культивування склалися оптимальні умови для накопичення ферменту молокозсідальної дії. З 20 по 30 добу культивування, як і при усіх інших значеннях рН, питома МЗА залишалася достовірно на одному рівні. Мінімальні значення МЗА при усіх стартових значеннях рН були зафіксовані на 10-у добу культивування і складали: при стартовому значенні рН поживного середовища 3 – 43 од/мг, при рН 4 – 103 од/мг, рН 5 – 99 од/мг, при рН рівному 6 – 81 од/мг. Максимальні значення МЗА були досягнуті штамом на 20-30 добу культивування. При початковому значенні рН поживного середовища рівному 3 – 111 – 114 од/мг, рН 4 – 152 – 155 од/мг,при рН 5 – 148 – 151 од/мг, при рН 6 – 125 – 129 од/мг. На основі отриманих даних можна стверджувати, що початкове значення рН поживного середовища на рівні 4 і 5 найсприятливіше для синтезу і накопичення протеїназ молокозсідальної дії.
2.3.7. Зміна концентрації білку в КФ гриба Tv-1 Trametesversicolor (l.) Pilat залежно від значення стартового рН поживного середовища і доби культивування.
Динаміку концентрації білку в культуральному фільтраті гриба Tv-1 Trametesversicolor (l.) Pilat можна бачити на малюнку 3.7. Дисперсійний аналіз показав достовірність впливу фактора “доба” і “рН поживного середовища” на накопичення білку в КФ гриба.
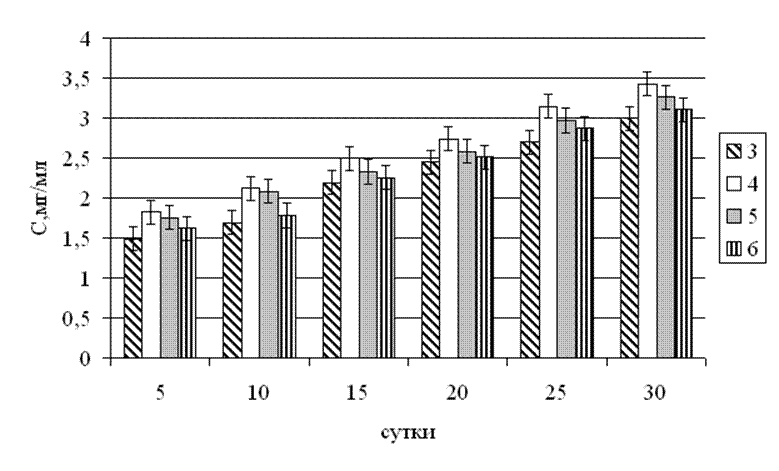
Рис.3.7. Динаміка концентрації білку в КФ гриба Tv-1 Trametesversicolor (l.) Pilat залежно від доби культивування і стартового рН поживного середовища.
Найбільш активне накопичення білку спостерігалося при стартових значеннях рН поживного середовища 4 і 5. На 5 добу культивування, при стартовому значенні рН 4, концентрація білку була мінімальною – 1,85 мг/мл, а на 30 добу досягла абсолютного максимуму – 3,45 мг/мл. У випадку із стартовим значенням рН поживного середовища рівному 5, мінімальне значення на 5 добу культивування складало 1,75 мг/мл, максимальне на 30 добу – 3,20 мг/мл. У випадок зі значення рН 3 і 6 мінімальне значення також спостерігається на 5-у добу культивування і складає 1,50 мг/мл і 1,60 мг/мл відповідно, а максимальне на 30 добу культивування – 3,00 мг/мл і 3,12 мг/мл. увесь випадок накопичення білок відбувається плавно.
2.3.8. Динаміка накопичення біомаси грибом Tv-1 Trametesversicolor залежно від доби культивування і зміни рН поживного середовища.
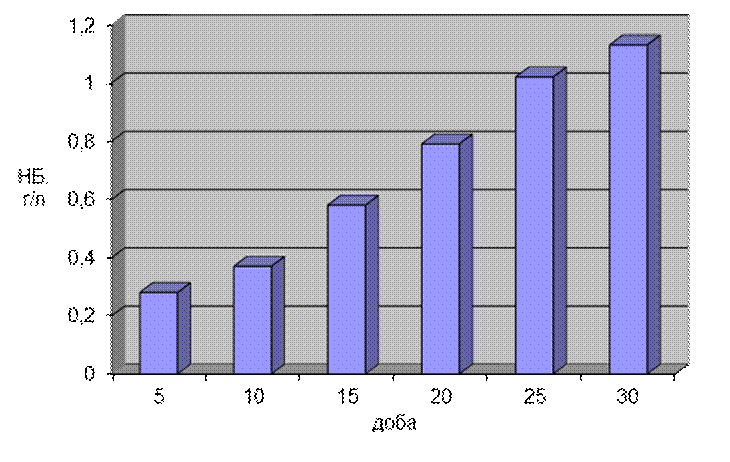
На малюнку 3.8 показана динаміка накопичення біомаси грибом Tv-1 Trametesversicolor (l.) Pilat при різних значеннях первинного рН середовища. Дісперсійний аналіз показав достовірність впливу фактора “доба” і “рН поживного середовища” на приріст біомаси. Було відмічено, що найдобріше гриб розвивався при стартовому значенні рН поживного середовища рівному 4. Мінімальна біомаса спостерігалася на 5 добу культивування (0,26 г/л). Абсолютно максимальне значення було досягнуте на 30 добу культивування (1,0 г/л). З 5 по 10 добу культивування при цьому значенні рН поживного середовища спостерігався незначний приріст біомаси. З 15 по 25 діб культивування ми спостерігали плавний приріст біомаси.
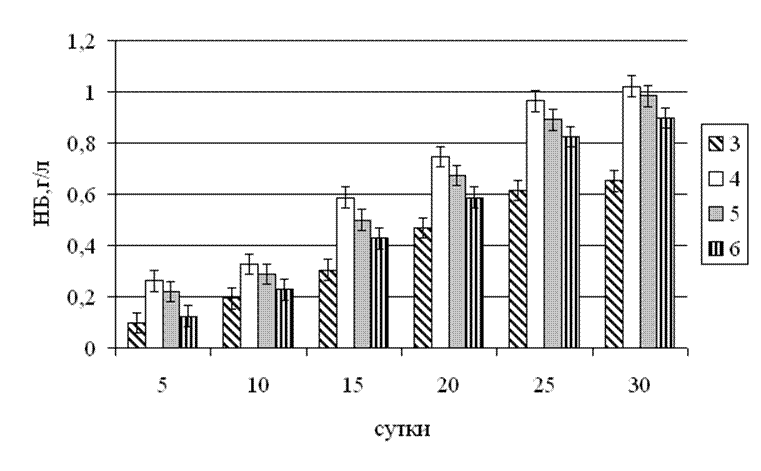
Рис.3.8. Динаміка накопичення біомаси грибом Tv – 1 Trametesversicolor при культивуванні на середовищах з різним значенням рН.
Інтенсивним було накопичення біомаси грибом при стартових значеннях рН поживного середовища 5 і 6. Абсолютний мінімум в обох випадках був відмічений на 5 добу культивування (0,21 г/л і 0,12 г/л відповідно). Абсолютно максимальні значення були зафіксовані на 30 добу культивування. При первинному значенні рН поживного середовища рівному 5 – 0,98 г/л, при рН 6 – 0,89 г/л. Найменший приріст біомаси був відмічений при первинному значенні рН поживного середовища рівному 3. На 5 добу культивування він складав 0,09 г/л. Максимальне значення було досягнуте на 30 добу культивування – 0,65 г/л. При усіх значеннях рН було відмічене зниження швидкості зростання біомаси з 25 по 30 добу культивування, що можна пояснити значним зменшенням поживних речовин необхідних для розвитку гриба.
2.3.9. Зміна кислотності культурального фільтрату гриба Tv-1 Trametesversicolor (l.) Pilat на поживних середовищах з різним стартовим рівнем кислотності.
Динаміка зміни рН середовища представлена на малюнку 3.9. Дисперсійний аналіз показав достовірність впливу чинника “рН поживного середовища” і “доба” на зміну рН після культивування гриба.
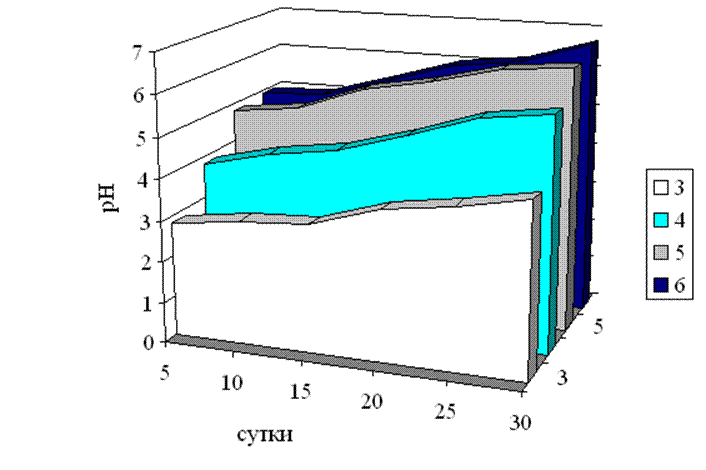
Рис.3.9. Зміна рН поживного середовища гриба Tv-1 Trametesversicolor (l.) Pilat на поживних середовищах залежно від стартового значення рН.
Фіксуючи значення рН в течії 30 добового культивування гриба нам вдалося відмітити, що при усіх стартових значеннях рН поживного середовища культура поступово підлужувала культуральну рідину. Слід так само вказати, що саме середовище не має буферних властивостей і тому при початковому значенні кислотності 6,0, після її стерилізації спостерігається незначне її падіння. Після 5 доби культивування рН починало плавно зростати і на 30 добу культивування були зафіксовані наступні значення: при стартовому значенні рН поживного середовища 3 – 4,2, при 4 – 5,7, при 5 – 6,4 при 6 – 6,7. Усе це вказує на те, що зі збільшенням термінів культивування в середовищі накопичується все більша кількість продуктів з більше лужними властивостями, ніж початкове середовище.
ВИСНОВКИ
На основі отриманих даних можна зробити наступні висновки:
- Культура Tv – 1 Trametesversicolor (l.) Pilat здатна синтезувати протеінази молокозсідальної дії.
- Максимальні значення загальної і питомої молокозсідальної активності у культури Tv – 1 Trametesversicolor (l.) Pilat спостерігаються на 25-30 добу культивування і складають в середньому 307 од/мл і 135 од/мг відповідно.
- Накопичення біомаси грибом відбувається поступово та на 30 добу культивування спостерігається його максимальне значення (1,13 г/л).
- Впродовж 30 діб культивування кислотність поживного середовища знаходиться в кислій зоні, що може свідчити про те, що грибом Тv – 1 Trametesversicolor (l.) Pilat виділяються речовини, які мають кислу природу.
- Початкова кислотність поживного середовища істотно впливає на молокозсідальну активність гриба Тv- 1 Trametesversicolor (l.) Pilat, що проявляється оптимальним значенням кислотності середовища в межах 4-5.
- Накопичення біомаси грибом Tv-1 Trametesversicolor (l.) Pilat найбільш інтенсивно відбувалося на поживних средовищах з початковим значенням рН 4-5
СПИСОК ЛІТЕРАТУРИ
1. Бєлова Н. В. Перспективи використання біологічно активних сполук вищих базидіоміцетів / Н. В. Бєлова // Микол. і фітопатол. – 2004. – Т. 38. – Вип. 2. – С. 1 – 6.
2. Білай В. І. Основи загальної мікології. – К .: Вища школа, 1980. – 360 с
3. Білай В. І. Методи експериментальної мікології / Білай В. І. // Довідник. – К .: Наук. Думка, 1982. – 550 с.
4. Бойко М. І. Базидіальні гриби як можливі продуценти протеїназ молокозсідальної дії / М. І. Бойко, О. В. Федотов, С. Ф. Негруцька, В. С. Антимонова // Інтродукція та акліматизація рослин на Україні. – К .: 1995. – С. 86 – 98.
5. Бойко М. І. Дереворазрушающие гриби – активне продуценты протеиназ молокосвёртивающего и тромболитического действия / М. І. Бойко, В. М. Стадничук // Сборник: Успехи медицинской микологии. – М .: Национальная академія микологии, 2003. – Т. 1. – С. 237 – 238.
6. Бойко С.М. Зміна молокозсідальної активності і продуктивності синтезу білків штамів IrpexlacteusFr. при тривалому культивуванні. Збірник наукових праць Луганського національного університету № 25, Луганськ, 2003 стор. 5-9
7. Бойко С. М. Вищі базидіоміцети – джерела біопрепаратів різної спрямованості / С. М. Бойко, С. І. Демченко, Ю. П. Загнітко, Ю. В. Мануйлова // Матеріали XII з’їзду українського ботанічного товариства, Одеса: 2006 . – С. 24 – 27.
8. Бухало А.С. Вищі їстівні базидіоміцети в чистій культурі. – К.: Наук.думка, 1988.- 143с.
9. Денисова Н. П. Природа і біологічна роль протеїназ базидіальних грибів / Н. П. Денисова // Микол. і фітопатол. – 1984. – т.18, №2. – С. 43 – 46.
10. Денисова Н. П. Протеїнази вищих базидіоміцетів / Н. П. Денисова // Мікологія і фітопатологія. – 1990. – т.24, № 6. – С. 478 – 485.
11. Дудка І. А., Вассер С. П. Гриби. Довідник міколога і грибника. – К .: Hаукова думка, 1987. – 535 с
12. Негруцька С. Ф. Базидіальні гриби – перспективні об’єкти біотехнології / С. Ф. Негруцька, М. І. Бойко, Л. П. Фільчаков, П. А. Сичов // Тез. доповідей проф.-викл. сост. за підсумками наук.-дослід. і метод. роботи. – Донецьк: 1995. – С. 102-103.
13. Низковская О. П. Белки, ферменти и стерини базидиальных грибов / О. П. Низковская // Методы исследования. – М .: Наука, 1979. – С. 72.
14. Семёнов С. М. Лабораторные среды для актиномицетов. Справочник / С. М. Семёнов. – М .: Агропромиздат, 1999 – 240 с.
15. Феофилова Е. П. Современные направления в изучении биологически активних веществ базидиальных грибов / Е. П. Феофилова // Прикладная биохимия и микробиология. – М .: Наука, 1998. – Т.34, №6. – С. 597 – 607.
Редакція може не поділяти думку авторів і не несе відповідальність за достовірність інформації. Будь-який передрук матеріалів з сайту може здійснюватись лише при наявності активного гіперпосилання на e-kolosok.org, а також на сам матеріал!