Немає жодного закону, яким керується будь-яка частина Всесвіту та який не був би задіяний у явищі горіння свічки. Немає кращого шляху, немає більш відкритих дверей, якими ви можете увійти до вивчення природознавства, ніж розгляд явищ, що відбуваються під час горіння свічки.
М. Фарадей
Історія
Неможливо уявити собі життя без світла. Сонце дарує нам його щодня, але його проміння проникає не всюди – є безліч приміщень та місць, де потрібне штучне освітлення. А з настанням темряви ми звичним порухом руки вмикаємо розмаїті світильники у своєму помешканні – продовжуємо день для роботи, дозвілля, домашніх потреб.
Наші далекі пращури гуртувалися навколо багаття у печерах, щоби приготувати їжу та погрітися. Кидаючи хисткі тіні на стіни печери, вогонь освітлював життя людей. При світлі вогню первісний художник малював на цих стінах життя племені. В основному це сцени полювання та інших дуже важливих подій. Згодом люди навчилися використовувати для освітлення скіпки та смолоскипи – найпростіші освітлювальні пристрої. Скіпка – тонка тріска сухого дерева, згоряла досить швидко і давала мало світла. Смолоскипи виготовляли із пучків бересту, соломи або ж скіпок, просякнутих смолою чи воском. Смолоскип горів довго за будь-якої погоди, і світла від нього було більше.
Чудовим винаходом та справжнім витвором декоративно-ужиткового мистецтва стала олійна лампа – каганець. Ними користувалися з доантичних часів аж до середини ХІХ століття, коли на зміну їм прийшла гасова лампа. 1853 року у місті Львові фармацевти Ігнацій Лукасевич та Ян Зег виробили методику дистиляції та очистки сирої нафти та вперше у світі отримали з неї гас. Вони дещо змінили конструкцію олійної лампи та заповнили її гасом. Гасова лампа була відзначена спеціальною грамотою на міжнародній виставці у Мюнхені, а І. Лукасевича та Я. Зега вважають батьками нафтопереробної промисловості. Гасову лампу ще й досі можна знайти на поличках господарських магазинів.
Віддамо належне й свічці, яка справно служить людям впродовж тисячоліть. Вона завжди присутня на Різдвяному та Великодньому столі; зі свічкою пов’язано багато церковних і народних обрядів. Панікадило (від гр. „πολυκάνδηλον” – багатосвіччя) – великий підвісний світильник у християнській церкві, на якому палало одразу багато свічок – стало прообразом електричних люстр у наших домівках і навіть елегантних та розкішних люстр Сваровскі, що освітлюють Метрополітен Оперу та Версаль. Від живого вогника свічки важко відвести погляд, а її мерехтливе світло наповнює простір довкола неї чимось загадковим та романтичним…

Гасова лампа
Попри розмаїття, всі згадані світильники об’єднані джерелом світла – полум’ям. Тому пригляньмося до нього пильніше, а за приклад візьмемо полум’я свічки. І як справжніх природодослідників нас цікавитиме не тільки історія розвитку освітлювальних пристроїв, а дещо інші питання. Чому свічка горить? Чому полум’я свічки жовте? Чому воно здіймається вгору? Та найголовніше – чому полум’я випромінює світло? Відповіді на ці, здавалося б, прості запитання потребують ґрунтовних знань з хімії та фізики.
Свічка
Віддавна свічки виготовляли з бджолиного воску або яловичого чи баранячого жиру. Свічки з жиру під час горіння виділяли багато кіптяви та неприємний запах, тому з часом жири замінили на стеарин або парафін. І віск, і жири, і парафін належать до органічних речовин – вуглеводнів та вуглеводів. Перші складаються лише з атомів Карбону (C) та Гідрогену (H), а до складу других додаються ще й атоми Оксигену (O). Наприклад, основним складником бджолиного воску є ефіри пальмітинової та церотинової кислот. Молекулярні формули цих речовин хіміки записують у такий спосіб: CH3[CH2]14COO[CH2]29CH3 та CH3[CH2]24COO[CH2]29CH3. Спробуйте підрахувати скільки атомів Карбону, Гідрогену та Оксигену є у кожній такій молекулі! Хімічні формули вуглеводнів виглядають простіше: CnH2n+2. Замість букви „n” у хімічній формулі можна підставити будь-яке число від одиниці до кількох десятків. Типовий вуглеводень, з якого роблять парафінові свічки, налічує 31 атом Карбону, тому атомів Гідрогену у складі молекули є 2 × 31 + 2 = 64. Температура плавлення речовин, з яких виготовляють свічки, коливається у межах 40–50 °С, а температура займання перевищує 370 °С. По суті, ці речовини є твердим паливом, яке можна як завгодно довго зберігати і за потреби використовувати.
Щоб свічку було легше запалити та щоб вона горіла тривалий час, використовують ґніт – пучок сплетених лляних або бавовняних ниток. Ґніт утворює серцевину свічки. Коли ми підносимо до свічки запаленого сірника, речовина свічки плавиться і підіймається вгору по нитках, наче по тонких канальцях. Рух рідин тонкими канальцями належить до так званих капілярних явищ. Далі під дією високої температури (адже сірник продовжує горіти!) розплавлений віск випаровується і… Ось тут і починається найцікавіше.
Хімія
Тепер нам вже не потрібен сірник чи запальничка. Органічні сполуки, що входять до складу свічки, займаються та горять. Полум’я свічки розплавлює все нові й нові порції воску, що піднімається по ґноту, випаровується й підтримує вогонь, доки не згорить уся свічка.
Але що таке горіння? Трохи більше ніж 200 років тому вважали, що горіння завдячує особливій субстанції – флогістону. Він заповнює собою всі займисті речовини та виділяється з них в процесі горіння. Тепер ми знаємо, що горіння – доволі складний процес на основі хімічних реакцій окиснення–відновлення. Суттєво, що в процесі таких реакцій виділяється велика кількість тепла та з’являється світіння.
Отже, під дією тепла речовина свічки плавиться, всмоктується ґнотом та випаровується з його поверхні – перетворюється у газ. Мовою науковців, енергія молекул речовини свічки при цьому зростає, а молекули речовин, що входять до складу свічки, починають коливатися швидше. Що вища енергія, то сильніші коливання молекул. Врешті коливання стають настільки сильними, що деякі молекули розпадаються на простіші. Таке явище називається піроліз. Але це ще не є вогнем. Менші молекули легше реагують з киснем, що міститься у навколишньому повітрі. Відтак, відбувається окиснення речовини, тобто горіння. Кінцевими продуктами згоряння будь-яких органічних речовин є вуглекислий газ CO2 та звичайна водяна пара H2O. Спрощено реакцію горіння парафіну у свічці можна записати так:
C31H64 + 47O2 g 31CO2 + 32H2O.
Проте важко уявити, що 94 атоми Оксигену одночасно з’єднуватимуться з 31 атомом Карбону та 64 атомами Гідрогену. Для цього потрібно, щоб розірвалося дуже багато хімічних зв’язків та утворилося ще більше нових зв’язків між атомами у молекулах. Це означає, що горіння – багатостадійний процес. Важко повірити, але у маленькому полум’ї свічки одночасно відбуваються тисячі різних хімічних реакцій!
Полум’я
Придивіться до полум’я свічки уважніше. Ви побачите, що внизу полум’я синє, а верхня його частина жовтувата. Полум’я свічки можна умовно поділити на чотири зони (мал. 1). Перша зона, поблизу ґнотика, не випромінює світло. Температура у цій зоні становить 600 °C. Тут випаровуються речовини свічки (тверде паливо), але кисню для горіння бракує. Друга зона знаходиться у нижній частині полум’я і випромінює слабке синє світло. Температура у цій зоні приблизно 800 °C. Тут, завдяки легкому доступу кисню із навколишнього повітря, відбувається горіння.

Мал. 1. У полум’ї свічки можна виділити чотири зони. Світло у другій зоні виникає завдяки хемілюмінесценції – випромінюванню збуджених молекул під час хімічних реакцій. Основний потік світла (жовтий вогник) йде від розжарених мікроскопічних часточок сажі у четвертій зоні
Перервемо розповідь про полум’я та згадаємо, що таке атом. Якщо молекула – це найменша частинка речовини, то атом – це найменша частинка, що відповідає хімічному елементові. Всі молекули складаються з атомів. Дуже спрощено атом можна уявити собі як своєрідну Сонячну систему у мініатюрі. Довкола ядра-Сонця кружляють по орбітах електрони-планети. Для нас зараз важливо знати: що далі від ядра перебуває електрон, то більшою енергією володіє атом. Кажуть, що такий атом з підвищеною енергією знаходиться у збудженому стані. А що станеться, коли атом зі збудженого стану повернеться до звичайного, з нижчою енергією? Виявляється, цей надлишок енергії може випромінитися у вигляді світла. Так само і збуджені молекули, повертаючись до нормального стану, випромінюють світло.
Синє світіння йде від збуджених радикалів1 СН та ОН, а також від молекул С2; усі вони утворюються завдяки хімічним реакціям. Явище випромінювання світла внаслідок перебігу хімічних реакцій називають хемілюмінесценцією, і саме вона є джерелом блакитного світла у нижній частині вогника свічки.
1Радикали (вільний радикал; від фр. „Radical” та лат. „radicalis” – „корінний”, „той, що має корінь”; від лат. „radix” – корінь) – атоми або молекули з неспареним електроном на зовнішній атомній або молекулярній оболонці. Радикали можуть бути нейтральні або нести позитивний чи негативний заряд.
Третя зона полум’я знаходиться всередині вогника, тут також бракує кисню. Завдяки теплу від хімічних реакцій другої зони температура у третій зоні підвищується до 1000 °C. Третя зона не випромінює світло, але за такої високої температури тут активно протікає піроліз. Деякі молекули твердого палива не встигають розкластися і згоріти до кінця. Вони утворюють сажу – мікроскопічні часточки, що складаються з вуглецю.
Гаряче повітря легше, ніж холодне, тому постійний висхідний потік повітря захоплює часточки сажі. Підіймаючись, часточки сажі дедалі більше нагріваються і потрапляють у четверту зону, де температура становить приблизно 1200 °C. Четверта зона якраз і є отим звичним для нас вогником свічки. Тут за високої температури часточки сажі розжарюються і світяться, так само, як залізний цвях у вогні.
Колір
Нам залишилося зробити останнє зусилля, щоб розгадати ще одну загадку свічки, а саме – колір полум’я. Отже, світло у вогнику свічки випромінюють розжарені часточки сажі. Відомо, що всі нагріті тіла випромінюють електромагнітні хвилі. Однією з основних характеристик хвилі є її довжина – відстань між сусідніми горбочками (або западинами) хвилі. Розподіл інтенсивності випромінювання хвиль різної довжини залежить від температури тіла. Зі збільшенням температури тіла максимум випромінювання зміщується у бік коротких довжин хвиль. Тому цвях, розжарюючись у вогні, змінює свій колір від темно-червоного до світло-жовтого. З усього розмаїття довжин хвиль лише невелику їхню частину людське око сприймає у вигляді світла. Колір світла залежить від довжини хвилі: короткі хвилі ми сприймаємо як синє світло, довші – як жовте та червоне.
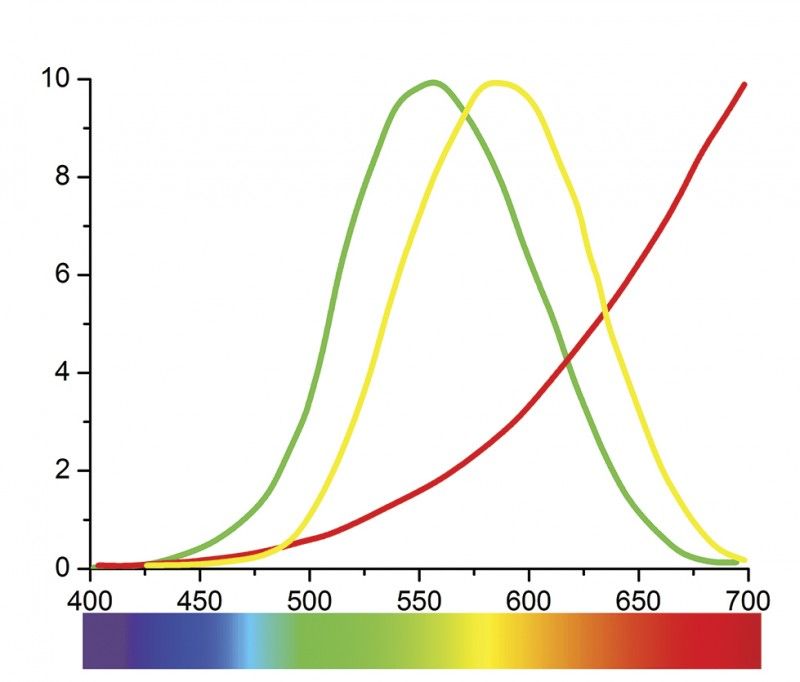
Мал. 2. Криві спектрального випромінювання полум’я свічки. Більшу частину випромінювання полум’я свічки, що припадає на червону ділянку ми бачимо дуже погано, тому вогник має жовтий колір
Розглянь малюнок 2. Внизу ви бачите кольорову смужку. Вона містить усі кольори, які бачить око – видимий спектр. Числа біля смужки означають довжини хвиль у нанометрах2, що відповідають певному кольору. Зелена крива на малюнку – це крива чутливості ока. Бачимо, що око найбільш чутливе до електромагнітних хвиль з довжиною 550 нанометрів (зелене світло). У той же час полум’я свічки найбільше світла випромінює у червоній та особливо у невидимій для людини інфрачервоній ділянці спектра (червона крива). Якщо ці дві криві скласти разом, то отримаємо іншу криву. Її форма дуже схожа на криву чутливості ока, але трохи зміщена вправо (жовта крива на малюнку 2). Ця крива і показує, світло якого кольору ми найкраще бачимо у полум’ї свічки. Найбільших значень крива набуває за довжин хвиль 570–580 нанометрів (жовте світло).
2Нанометр – це одна мільярдна частина метра.
Тепер ви розумієте, чому Фарадей з таким захопленням говорив про свічку? Нам довелося згадувати про хімічні реакції та атомно-молекулярну будову речовини, про капілярні явища, випаровування та конвекцію (висхідні потоки нагрітого повітря), про люмінесценцію та теплове випромінювання. Справді, майже всі закони природи сконцентрувалися у мерехтливому вогнику свічки! А ми наостанок продемонструємо те, чого Фарадей не міг знати: як полум’я свічки виглядає у невагомості (мал. 3).
Гаряче повітря з другої зони у невагомості не підніматиметься угору, адже воно так само не має ваги, як і холодне. За таких умов притік кисню у другу зону дуже слабкий і горіння відбувається повільно. Температура для піролізу та утворення, а тим більше розжарення часточок сажі недостатня. Тому світло від полум’я у невагомості йтиме лише завдяки хемілюмінесценції і матиме блакитний колір. Такий вогник за відсутності сили тяжіння ледь помітний у темряві і не придатний для освітлення.
Якщо ти хочеш дізнатися про свічку ще більше та самому зробити цікаві експерименти з її полум’ям, прочитай захоплюючу книжку Майкла Фарадея „Історія свічки”, а наша наступна розповідь буде про те, як отримати світло за допомогою електрики.